下列溶液中微粒的物质的量浓度关系一定正确的是( )
A.某二元弱酸的酸式盐NaHA溶液中:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
B.0.2 mol/L NH4Cl溶液和 0.1 mol/L NaOH溶液等体积混合:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)
D.25℃时,pH=8的CH3COONa稀溶液中:c(CH3COOH)=9.9×10-7 mol/L
答案:D
A项溶液中电荷不守恒,应为:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)。B项溶液中,反应后生成等物质的量的NH4Cl、NaCl和NH3·H2O,c(Cl-)>c(NH4+)。C项中酸、碱的强弱不确定,反应后所得的溶液可能显酸性、中性或碱性。D项溶液中,电荷守恒式为:c(Na+)+c(H+)=c(CH3COO-)+c(OH-);物料守恒式为:c(Na+)=c(CH3COO-)+c(CH3COOH),则c(CH3COOH)=c(OH-)-c(H+)=(10-6-10-8) mol/L=9.9×10-7 mol/L。

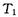 ;另一种形式是有三颗星位于边长为a的等边三角形的三个项点上,并沿外接于等边三角形的圆形轨道运行,其运动周期为
;另一种形式是有三颗星位于边长为a的等边三角形的三个项点上,并沿外接于等边三角形的圆形轨道运行,其运动周期为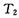 ,而第四颗星刚好位于三角形的中心不动.试求两种形式下,星体运动的周期之比
,而第四颗星刚好位于三角形的中心不动.试求两种形式下,星体运动的周期之比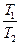 .
.