问题
选择题
25 ℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1 L的溶液,溶液中部分微粒与pH的关系如图所示。下列有关溶液中离子浓度关系叙述,正确的是

A.W点所示的溶液中:c(Na+)+c(H+)=2c(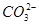 )+c(OH-)+c(Cl-)
)+c(OH-)+c(Cl-)
B.pH=4的溶液中:c(H2CO3)+c( )+c(
)+c(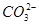 )<0.1 mol·L-1
)<0.1 mol·L-1
C.pH=8的溶液中:c(H+)+c(H2CO3)+c( )=c(OH-)+c(Cl-)
)=c(OH-)+c(Cl-)
D.pH=11的溶液中:c(Na+)>c(Cl-)>c(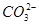 )>c(
)>c( )>c(H2CO3)
)>c(H2CO3)
答案
答案:B
对A项,根据电荷守恒知,c(Na+)+c(H+)=2c( )+c(
)+c(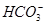 )+c(OH-)+c(Cl-),此时c(
)+c(OH-)+c(Cl-),此时c(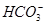 )=c(
)=c( ),A错误;对B项,pH=4时,c(
),A错误;对B项,pH=4时,c( )=c(
)=c(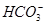 )≈0,c(H2CO3)略大于0.02 mol·L-1,显然B正确;对C项,根据电荷守恒:c(Na+)+c(H+)=2c(
)≈0,c(H2CO3)略大于0.02 mol·L-1,显然B正确;对C项,根据电荷守恒:c(Na+)+c(H+)=2c( )+c(
)+c(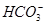 )+c(OH-)+c(Cl-),根据物料守恒:c(Na+)=2c(H2CO3)+2c(
)+c(OH-)+c(Cl-),根据物料守恒:c(Na+)=2c(H2CO3)+2c(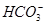 )+2c(
)+2c( ),可推出c(H+)+2c(H2CO3)+c(
),可推出c(H+)+2c(H2CO3)+c(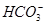 )=c(OH-)+c(Cl-),C错误;对D项,c(
)=c(OH-)+c(Cl-),C错误;对D项,c(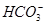 )最大时,Na2CO3与HCl是等物质的量(均为0.1 mol)反应的时刻(图中pH=8~9时),故pH=11时,HCl的物质的量远小于0.1 mol,而此时
)最大时,Na2CO3与HCl是等物质的量(均为0.1 mol)反应的时刻(图中pH=8~9时),故pH=11时,HCl的物质的量远小于0.1 mol,而此时 约为0.08 mol,故pH=11时,肯定是c(
约为0.08 mol,故pH=11时,肯定是c( )>c(Cl-),D错误。
)>c(Cl-),D错误。
