现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A溶液、B溶液、C溶液、D溶液进行实验。实验过程和记录如图所示(无关物质已经略去):
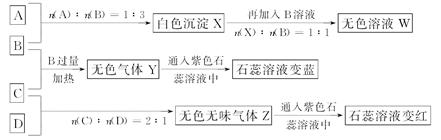
请回答:
(1)Y、Z的化学式分别为:Y________;Z__________。
X与B反应的离子方程式为_________________________________________________。
(2)D溶液pH________7(填“大于”“小于”或“等于”),原因是(用离子方程式表示)______________________________
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是__________________。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式________________________________
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是___________________________
(1)NH3 CO2 Al(OH)3+OH-=[Al(OH)4]-
(2)大于 CO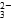 +H2O
+H2O HCO
HCO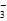 +OH-
+OH-
(3)NaOH>Na2CO3>AlCl3>NH4HSO4
(4)NH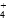 +H++2OH-
+H++2OH- NH3↑+2H2O
NH3↑+2H2O
(5)[Na+]>[SO ]>[NH
]>[NH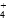 ]>[H+]=[OH-]
]>[H+]=[OH-]
根据A、B反应的物质的量之比及沉淀和B反应的物质的量之比可知,A为AlCl3,B为NaOH;NaOH与C反应可产生使石蕊溶液变蓝的气体,则C为NH4HSO4,D为Na2CO3。
(5)由于NH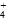 水解使溶液呈酸性,而NaOH、NH4HSO4的稀溶液混合后(不加热)溶液呈中性,则NaOH的物质的量比NH4HSO4的大,该混合溶液中离子浓度从大到小的顺序是[Na+]>[SO
水解使溶液呈酸性,而NaOH、NH4HSO4的稀溶液混合后(不加热)溶液呈中性,则NaOH的物质的量比NH4HSO4的大,该混合溶液中离子浓度从大到小的顺序是[Na+]>[SO ]>[NH
]>[NH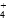 ]>[H+]=[OH-]。
]>[H+]=[OH-]。
