问题
选择题
在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是
A.1 L 0.1 mol·L-1(NH4)2Fe(SO4)2·6H2O的溶液中:c(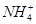 )+c(Fe2+)+c(H+)=c(OH-)+c(
)+c(Fe2+)+c(H+)=c(OH-)+c(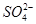 )
)
B.0.1 mol·L-1 NH4HS溶液中:c(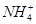 )=c(HS-)+c(H2S)+c(S2-)
)=c(HS-)+c(H2S)+c(S2-)
C.0.1 mol·L-1 pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-)
D.等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(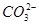 )=c(
)=c(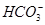 )+3c(H2CO3)+2c(H+)
)+3c(H2CO3)+2c(H+)
答案
答案:D
A项溶液中电荷守恒关系为c(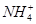 )+2c(Fe2+)+c(H+)=c(OH-)+2c(
)+2c(Fe2+)+c(H+)=c(OH-)+2c(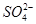 ),A错误;一部分
),A错误;一部分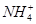 水解转化为NH3·H2O,根据物料守恒可得:c(
水解转化为NH3·H2O,根据物料守恒可得:c(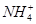 )+c(NH3·H2O)=c(HS-)+c(H2S)+c(S2-),B错误;HA-存在两个平衡:HA-
)+c(NH3·H2O)=c(HS-)+c(H2S)+c(S2-),B错误;HA-存在两个平衡:HA- H++A2-,HA-+H2O
H++A2-,HA-+H2O H2A+OH-,因为是酸性溶液,即HA-的电离程度大于其水解程度,则有c(A2-)>c(H2A),C错误;由电荷守恒可得c(Na+)+c(H+)=c(
H2A+OH-,因为是酸性溶液,即HA-的电离程度大于其水解程度,则有c(A2-)>c(H2A),C错误;由电荷守恒可得c(Na+)+c(H+)=c(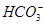 )+2c(
)+2c(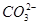 )+c(OH-)①,由题意可知,钠元素和碳元素物质的量之比为3∶2,由物料守恒可得:2c(Na+)=3c(
)+c(OH-)①,由题意可知,钠元素和碳元素物质的量之比为3∶2,由物料守恒可得:2c(Na+)=3c(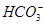 )+3c(H2CO3)+3c(
)+3c(H2CO3)+3c(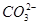 )②,①×2-②,D正确。
)②,①×2-②,D正确。
