问题
选择题
下列物质的量浓度关系错误的是
A.等物质的量浓度的HA溶液与MOH溶液等体积混合:c(H+)+c(M+)=c(OH-)+c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:
c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D.0.1 mol·L-1的NaHCO3溶液:c(Na+)>c(OH-)>c(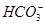 )>c(H+)
)>c(H+)
答案
答案:D
利用电荷守恒即可得出A项正确;由于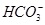 的酸性比CH3COOH的酸性弱,所以
的酸性比CH3COOH的酸性弱,所以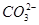 水解的程度大,其c(Na2CO3)<c(CH3COONa),而NaOH是电离出OH-,故B项正确;利用原子守恒2c(Na+)=c(CH3COO-)+c(CH3COOH)和电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)乘以2联立,消去c(Na+)即可得出c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),C项正确;D项
水解的程度大,其c(Na2CO3)<c(CH3COONa),而NaOH是电离出OH-,故B项正确;利用原子守恒2c(Na+)=c(CH3COO-)+c(CH3COOH)和电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)乘以2联立,消去c(Na+)即可得出c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),C项正确;D项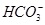 水解微弱,其浓度应该大于OH-的浓度,D项不正确。
水解微弱,其浓度应该大于OH-的浓度,D项不正确。
