(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.
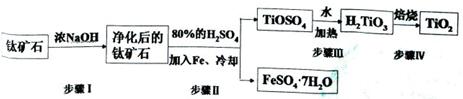
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
(1)除去Al2O3和SiO2 (2)FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
(3) 蒸发浓缩、冷却结晶 MnO2 + 2Fe2+ + 4H+ ="=" Mn2+ + 2Fe3+ + 2H2O
(4)溶液中存在平衡:TiO2++2H2O H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3。
H2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3。
(5)当滴入最后一滴NH4Fe(SO4)2溶液时,溶液变为血红色且半分钟内不褪色,则说明达到终点,1.50mol/L
题目分析:(l)在钛矿石中含有的Al2O3和SiO2能够与NaOH发生反应变为容易溶于水的物质。因此步骤I的目的是除去Al2O3和SiO2。(2)步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式是FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;(3)由于FeSO4的溶解度受温度的影响变化较大,所以从溶液中获得晶体的操作步骤II中经过蒸发浓缩、冷却结晶、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体。Fe2+有还原性,MnO2有氧化性,在酸性条件下发生氧化还原反应。该反应的两种方程式是MnO2 + 2Fe2+ + 4H+ =Mn2+ + 2Fe3+ + 2H2O;(4) 在溶液中存在水解平衡:TiO2++2H2O H2TiO3+2H+,水解反应是吸热反应。当加入热水升高温度后,促进盐的水解,水解平衡正向移动,会生成更多的H2TiO3,从而促使物质的转化。(5)①在原来的溶液中含有Fe3+,以以KSCN溶液为指示剂,此时溶液是红色,其中存在平衡:Fe3++3SCN-
H2TiO3+2H+,水解反应是吸热反应。当加入热水升高温度后,促进盐的水解,水解平衡正向移动,会生成更多的H2TiO3,从而促使物质的转化。(5)①在原来的溶液中含有Fe3+,以以KSCN溶液为指示剂,此时溶液是红色,其中存在平衡:Fe3++3SCN- Fe(SCN)3.随着铝粉的不断加入,c(Fe3+)不断降低,平衡逆向移动,红色逐渐变浅,当滴入最后一滴NH4Fe(SO4)2溶液时,溶液变为血红色且半分钟内不褪色,则说明达到终点;②根据电子转移数目相等可得关系式:3TiO2+~Al~3Fe3+.n(Fe3+)="0.1mol/L×0.03L×5=0.015mol." n(TiO2+)=" 0.015mol," 所以待测钛液中TiOSO4的物质的量浓度是c(TiO2+)= 0.015mol÷0.01L=1.50mol/L.
Fe(SCN)3.随着铝粉的不断加入,c(Fe3+)不断降低,平衡逆向移动,红色逐渐变浅,当滴入最后一滴NH4Fe(SO4)2溶液时,溶液变为血红色且半分钟内不褪色,则说明达到终点;②根据电子转移数目相等可得关系式:3TiO2+~Al~3Fe3+.n(Fe3+)="0.1mol/L×0.03L×5=0.015mol." n(TiO2+)=" 0.015mol," 所以待测钛液中TiOSO4的物质的量浓度是c(TiO2+)= 0.015mol÷0.01L=1.50mol/L.

 全冠修复,边缘密合,无悬突,戴用1个月后,出现牙龈炎。其病因与以下哪些因素有关()
全冠修复,边缘密合,无悬突,戴用1个月后,出现牙龈炎。其病因与以下哪些因素有关()