对金属制品进行抗腐蚀处理,可延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
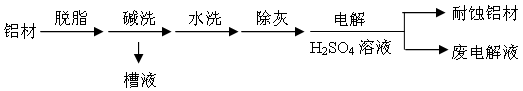
① 碱洗的目的是除去铝材表面的自然氧化膜,为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4溶液中电解,铝材表面形成氧化膜,阳极电极反应为 。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是 。
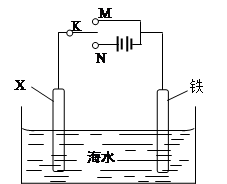
(3)利用下图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于 处。
(1)①b(2分)
②2Al+3H2O-6e-=Al2O3+6H+(2分);HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀(2分)
(2)阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定(2分)(3)N (2分) M(2分)
题目分析:(1)①铝能与强碱反应产生氢气,Al(OH)3具有两性,既能与强碱反应也能与强酸反应生成盐和水,碱洗槽液中有AlO2-,故应通入CO2来回收Al(OH)3,发生反应2AlO2-+3H2O+CO2═2Al(OH)3↓+CO32-或CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓;若加HNO3,生成的沉淀还会继续溶解,故答案为b;
②铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为:2Al+3H2O-6e-=Al2O3+6H+;加入NaHCO3溶液后产生气泡和白色沉淀,是由于HCO3-与H+反应使H+浓度减小,产生Al(OH)3沉淀;
(2)电镀铜时用铜做阳极,阳极上铜被氧化,电解质溶液浓度不变,用铜作电极可及时补充电镀液中消耗的Cu2+,保持其浓度恒定,采用石墨无法补充Cu2+,故答案为:阳极Cu可以发生氧化反应生成Cu2+,补充溶液中消耗的Cu2+,保持溶液中Cu2+浓度恒定;
(3)金属的防护有牺牲阳极的阴极保法和外加电源的阴极保护法,若X为碳棒,为减缓铁的腐蚀,K置于N处,必须让被保护的金属接电源负极作阴极;若开关K置于M处,形成原电池,锌作负极,为牺牲阳极保护法(或牺牲阳极的阴极保护法)。
