问题
单项选择题
可能用到的相对原子质量:
H-1 He-4 C-12 N-14 O-16 S-32 Fe-56
已知:①2CO(g)+O2(g)====2CO2(g);ΔH1=-566kJ·mol-1;
②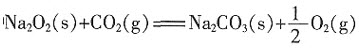 ;ΔH2=-266kJ·mol-1。
;ΔH2=-266kJ·mol-1。
根据以上热化学方程式判断,下列说法正确的是()。
A.CO的燃烧热为-566kJ·mol-1
B.图可表示由CO生成CO,的反应过程和能量关系
C.2Na2O2(s)+2CO2(g)====2Na2CO3(s)+O2(g);ΔH3=-452kJ·mol-1
D.CO(g)与Na2O2(s)反应放出549kJ热量时,转移的电子数为12.04×1023
答案
参考答案:D
解析:
燃烧热是1mol的物质完全燃烧时反应所放出的能量,CO的燃烧热为283kJ/mol,A项错误;B项图中没有表示出ΔH=-566kJ/mol时对应的反应物与生成物的量的关系,B项错误;由于2Na2O2(s)+2CO2(g)====2Na2CO3(s)+O2(g);ΔH=-532 kJ/mol,C项错误;由盖斯定律得:CO(g)+Na2O2(s)====Na2CO3(s);ΔH=-549kJ/mol,可知当放出549 kJ热量时,消耗1mol CO,电子转移数为2×6.02×1023=12.04×1023,D项正确。
