甲公司位于H省B市,乙公司位于W省S市。2011年4月1日,甲公司向乙公司发出要约,要约中写明:甲公司向乙公司购买3000台光华牌照相机,每台照相机200元,交货地点在H省B市的丙仓库,交货时间是2011年5月1日;如接受上述条件,请于4月15日前回复。要约于4月2日到达乙公司信箱。乙公司收件员于4月3日从信箱中收取信件。乙公司高层研究后,于2011年4月12日向甲公司回复,内容为:我公司全部接受你方条件,但需要签订书面合同。信件于2011年4月13日到达甲公司信箱。甲公司领导在4月14日看见此书信。后双方董事长于4月18日在E省Q市签订了合同。
承诺生效的时间是:( )。
A.4月3日
B.4月12日
C.4月13日
D.4月14日
参考答案:C

 ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O Cu(NO3)2
Cu(NO3)2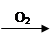 CuO
CuO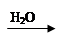 Cu(OH)2
Cu(OH)2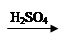 CuSO4
CuSO4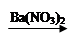 Cu(NO3)2
Cu(NO3)2