Ⅰ.某学生设计了用新制氯水、KSCN溶液、0.1mol•L-1FeCl2溶液探究Fe2+和Fe3+的转化条件实验.操作为:取少量久置的FeCl2溶液,滴加KSCN溶液,再滴入氯水.
(1)写出该实验发生的离子反应方程式______;
(2)实际操作中出现了异常现象,FeCl2溶液滴入KSCN后就出现了浅红色,请分析最可能的原因______;
(3)由上述异常现象该同学联想到用KI淀粉溶液检验食用盐中IO3-的实验,检验原理是:IO3-+5I-+6H+=3I2+3H2O.为此进行了一系列探究实验如下:
| 实验 | 操作步骤 | 现象 |
| 1 | 取少量加碘食盐溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 2 | 取少量NaCl溶解,滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡 | 溶液变蓝 |
| 3 | 取少量水… | 溶液变蓝 |
(4)经讨论,将KI换成其他试剂重新设计方案并取得了成功.你认为代替KI的可以是______
A.Na2SO3 B.Vc C.FeSO4 D.FeCl3
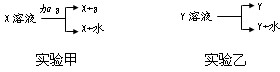
Ⅱ.从X、Y两种溶液中分离固体X、Y的方法为
(1)实验甲中a应具有的性质为______;
(2)实验乙一般在______条件下实现,并借助下图中______装置分离出Y.
Ⅰ(1)氯气有强氧化性,二价铁离子有还原性,所以氯气能氧化二价铁离子生成三价铁离子;三价铁离子能和硫氰化钾溶液发生络合反应,
故答案为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3 ;
(2)二价铁离子能被空气中的氧气氧化生成三价铁离子,故答案为:Fe2+被空气中的氧气氧化了;
(3)该反应必须在酸性条件下反应,加入碘化钾溶液后充分振荡,碘离子被氧气氧化成碘单质,4I-+O2+4H+=2I2+2H2O,
故答案为:滴入几滴稀硫酸,滴入少量KI淀粉溶液,振荡;4I-+O2+4H+=2I2+2H2O;
(4)碘化钾和碘酸钾的反应中碘化钾作还原剂,所以只要是具有还原性的物质就可代替碘化钾,亚硫酸根离子、Vc和二价铁离子都具有还原性,所以可以代替碘化钾,
故答案为:ABC;
Ⅱ(1)从实验甲知,该实验是把溶质从一种溶剂转移到另一种溶剂中,应采取采取的方法,所以a是萃取剂,萃取剂必须易溶解X不溶于水,不与X也不与水反应,
故答案为:易溶解X不溶于水不与X也不与水反应;
(2)过实验乙知,该实验是从溶剂中析出部分溶质,采用较少溶剂或降低溶解度的方法,所以应在降低温度或蒸发溶剂条件下实现;固体和液体分离采取过滤的方法,
故答案为:降温或蒸发;A.
