将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol•L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如图所示:
(1)写出OA段所发生反应的离子方程式______、______.
(2)当加入35mL盐酸时,产生CO2的体积为______mL(标准状况).
(3)计算原混合物中NaOH的质量及碳酸钠的质量分数______.
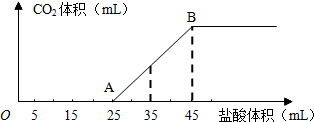
(1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段0~5mL先发生酸碱中和,
其离子反应方程式为H++OH-═H2O,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,其离子反应方程式为CO32-+H+═HCO3-,
故答案为:H++OH-═H2O;CO32-+H+═HCO3-;
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,
设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(35-25)×10-3L×1mol•L-1=0.01mol,则
HCO3-+H+═CO2↑+H2O
1 1
0.01mol n
=1 1
,解得n=0.01mol,标准状况下其体积为0.01mol×22.4L/mol=0.224L=224mL,0.01mol n
故答案为:224;
(3)设碳酸钠、碳酸氢钠和氢氧化钠的物质的量分别为x、y、z,则
①x+y=1mol/L×(0.045-0.025)L
②x+z=1mol/L×0.025L
③84g/mol•x+106g/mol•y+40g/mol•z=2.5g
联立①②③式解得x=0.01mol,y=0.01mol,z=0.015mol
故NaOH的质量为0.015mol×40g/mol=0.6g,
Na2CO3的质量分数为
×100%=42.4%,0.01mol×106g/mol 2.5g
答:原混合物中NaOH的质量为0.6g,碳酸钠的质量分数为42.4%.
