将1mol氧气和一定量的HCl放入2L的密闭容器中,420℃时,在催化剂作用下发生反应:4HCl+O2

2Cl2+2H2O.5分钟后反应达到平衡,将容器中的混合气体通过过量NaOH溶液,消耗NaOH 2.0mol;再将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2g.
请回答下列问题:
(1)写出平衡时,混合气体通入NaOH溶液中所发生反应的离子方程式.
(2)计算0~5分钟时,Cl2的平均生成速率是多少.
(3)计算平衡时HCl的转化率.
反应为可逆反应,混合气体中有HCl、Cl2等,混合气体通过过量NaOH溶液,HCl与NaOH溶液反应,生成氯化钠与水.Cl2与NaOH溶液反应,生成氯化钠、次氯酸钠与水.共消耗NaOH 2.0mol,根据钠原子守恒可知n(NaCl)+n(NaClO)=2mol,根据氯原子守恒可知原来HCl的物质的量n(HCl)=2mol.
将剩余气体干燥后通过焦性没食子酸的碱性溶液吸收O2,溶液增重19.2g为反应剩余的氧气的质量,所以剩余氧气的物质的量为
=0.6mol.19.2g 32g/mol
(1)混合气体中有HCl、Cl2等,HCl与NaOH溶液反应,生成氯化钠与水,离子方程式为H++OH-=H2O.
Cl2与NaOH溶液反应,生成氯化钠、次氯酸钠与水,反应离子方程式为Cl2+OH-=Cl-+ClO-+H2O.
答:混合气体通入NaOH溶液中所发生反应的离子方程式为H++OH-=H2O;Cl2+OH-=Cl-+ClO-+H2O.
(2)4HCl+O2

2Cl2+2H2O
开始(mol):2 1 0 0
变化(mol):1.6 1-0.6=0.4 0.8 0.8
所以5分钟内,Cl2的平均生成速率v(Cl2)=
=0.08 mol•L-1•min-1.0.8mol 2L 5min
答:5分钟内,Cl2的平均生成速率0.08 mol•L-1•min-1.
(3)原来HCl的物质的量n(HCl)=2mol.
由(2)可知参加反应的氯化氢的物质的量为1.6mol,
所以氯化氢的转化率为
×100%=80%.1.6mol 2mol
答:氯化氢的转化率为80%.

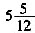 米,后轮周长为
米,后轮周长为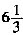 米,则前进多少米才能使前轮转的圈数比后轮转的圈数多99圈()
米,则前进多少米才能使前轮转的圈数比后轮转的圈数多99圈()