碱式碳酸铜可表示为:xCuCO3·yCu(OH)2·2H2O,测定碱式碳酸铜组成的方法有多种。
(1)现采用氢气还原法,请回答如下问题:
①写出xCuCO3·yCu(OH)2·zH2O与氢气反应的化学方程式______。
②实验装置用下列反有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):
(a)→( )( )→( )( )→( )( )→( )( )→( )( )→(1)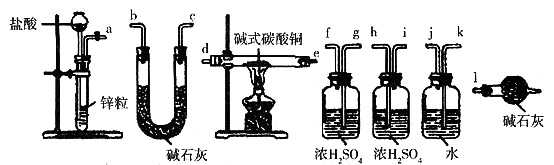
③称取23.9g某碱式碳酸铜样品,充分反应后得到12.7g残留物,生成4.4g二氧化碳和7.2g水。该样品的结晶水质量为______g,化学式为______。
(2)某同学以氮气代替氢气,并且用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?请说明理由______。
参考答案:
(1)①
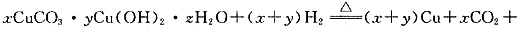 (x+2y+z)H2O
(x+2y+z)H2O
②a→kj→gf(或hi)→de(或ed)→hi(或gf)→bc(或cb)→1
③1.8 CuCO2·Cu(OH)2·H2O
(2)可以
根据反应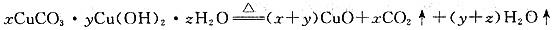
依据碱式碳酸铜样品、CuO、CO2和H2O质量(或其中任意三个量),即可计算出其组成。
解析:
本题是涉及物质成分测定的实验题。
(1)①碱式碳酸铜在受热的条件下分解产生CuO、CO2和H2O,因为用氢气还原法CuO要被还原为Cu,故反应的产物为:Cu、CO2、H2O,方程式略。②结合实验目的可知a中提供H2(混有HCl、H2O等),故通入碱式碳酸铜前应进行除杂,a→kj(注意:洗气瓶是长进短出,除HCl)→gf(或hi)[除H2O]→de(或ed)→hi(或gf)[吸收反应产生的H2O]→bc(或cb)[吸收反应产生的CO2]→1(防止空中的H2O、CO2进入装置,引起误差)。③反应得到的12.7g残留物为Cu,结合Cu、CO2的质量可知样品中含CuCO3、Cu(OH)2的物质的量均为0.1mol,故该样品中结晶水的质量为23.9g-123.5g/mol×0.1mol-97.5g/mol×0.1mol=1.8g,故可推知样品中CuCO3、Cu(OH)2、H2O的物质的量之比为1:1:1,故样品的化学式为CuCO3·Cu(OH)2·H2O。
(2)可以用氮气代替H2,因碱式碳酸铜在受热的条件下分解产生CuO、CO2和H2O,利用氮气将其产生的气体全部赶出反应器,分别被充分吸收后,利用样品以及CuO、CO2和H2O的质量(或其中的任三个数据)可计算出来其组成。
