已知固体A的焰色反应呈黄色,D、G常温下呈气态,化合物E为淡黄色固体粉末,A、B、C、D、E、F、G有如图转化关系:
回答下列问题:
(1)写出下列物质的化学式:
A______,E______.
(2)写出下列反应的化学方程式,是离子反应的写离子方程式.
反应①:______,A的溶液与F的溶液混合:______.
(3)经反应③产生的G在标准状况下为1.12L,则该反应中转移的电子的物质的量为______mol,此反应中消耗的E的质量为______g.
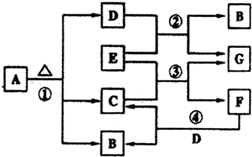
(1)根据图示可知A是含有钠元素的化合物,受热分解生成三种产物,所以A是碳酸氢钠,气体D是二氧化碳,化合物E为淡黄色固体粉末,能和二氧化碳反应,所以E是过氧化钠,过氧化钠和二氧化碳反应生成气体氧气和碳酸钠,所以G是氧气,B是碳酸钠,所以C是水,过氧化钠和水反应生成氢氧化钠和氧气,所以F是氢氧化钠,故答案为:NaHCO3;Na2O2;
(2)碳酸氢钠固体分解的方程式为:2NaHCO3
Na2CO3+CO2↑+H2O,碳酸氢钠和氢氧化钠混合,反应实质是HCO3-+OH-=CO32-+H2O, △ .
故答案为:2NaHCO3
Na2CO3+CO2↑+H2O;HCO3-+OH-=CO32-+H2O; △ .
(3)反应③的化学方程式为:2Na2O2+2H2O=4NaOH+O2↑,化合价发生变化的元素只有氧元素,Na2O2中氧元素化合价是-1价,产物中氧元素化合价为0价和-2价,Na2O2氧化剂又是还原剂,根据方程式并结合氧元素化合价可知每有2mol过氧化钠反应,则转移电子2mol,同时生成氧气1mol,当产生的氧气在标准状况下为1.12L(即0.05mol)时,则该反应中转移的电子的物质的量为0.1mol,消耗过氧化钠0.1mol,即7.8g,故答案为:0.1;7.8.
