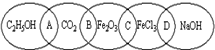
下图为五个椭圆交叉构成的图案,椭圆内分别写了C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题:
(1)两种物质都是非电解质的是______(填分类标准代号,下同),两种物质在水溶液中都能导电的是______.
(2)分类标准代号C表示______(多项选择)
a.两物质都是电解质b.两物质都可与酸反应
c.两物质都有氧化性d.两物质可以通过一步反应相互转化
(3)上述五种物质中的某一物质能与某种强酸反应生成上述中的另一种物质,该反应的化学方程式为______.
(4)图中相连的两种物质可归为一类,又能相互反应的是______(填分类标准代号),其反应的基本类型是______反应.
(5)用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热呈红褐色,得到的分散系称为______,该反应的化学方程式为______.
(1)在水溶液里或熔融状态下都不导电的化合物是非电解质,乙醇和二氧化碳都是非电解质,故选A;
含有自由移动的离子的水溶液就能导电,易溶性的电解质溶液就能导电,故选D.
故答案为:A;D;
(2)a、Fe2O3在熔融状态下能导电,FeCl3的水溶液能导电,所以这两种物质都是电解质,故a正确.
b、Fe2O3能和酸反应生成盐和水,FeCl3和一般的酸不反应,故b错误.
c、Fe2O3和FeCl3中的铁元素都是最高价,所以都有氧化性,故c正确.
d、Fe2O3和盐酸反应生成氯化铁是一步转化;加热氯化铁溶液至蒸干,发生的反应有:氯化铁水解生成氢氧化铁,氢氧化铁加热分解生成氧化铁,所以是两步反应,故d错误.
故选ac;
(3)某一物质能与某种强酸反应生成上述中的另一种物质,所以这两种物质应有相同的元素,且化合价不变,所以是氧化铁和氯化铁,
化学反应方程式为:Fe2O3+6HCl=2FeCl3+3H2O,故答案为:Fe2O3+6HCl=2FeCl3+3H2O;
(4)根据各物质的性质分析,只有氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,该反应中没有化合价的变化,所以是复分解反应.
故答案为:D; 复分解反应;
(5)该方法是制作氢氧化铁胶体,反应方程式为FeCl3+3H2O
Fe(OH)3(胶体)+3HCl △ .
故答案为:胶体;FeCl3+3H2O
Fe(OH)3(胶体)+3HCl. △ .
