问题
选择题
在海水的综合利用中,海水提溴工业是一个重要组成部分,其中一种提溴的工艺是在预先浓缩并酸化的海水中,通入足量氯气,然后使生成的溴与吸收剂SO2反应转化为氢溴酸以达到富集溴元素的目的.有关上述工艺流程的以下化学用语中,不正确的是( )
A.海水中Br-的电子式为:

B.海水中通入氯气时发生反应的离子方程式为:2Br-+Cl2=Br2+2Cl-
C.Cl-的结构示意图为:
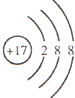
D.SO2吸收溴单质时发生反应的化学方程式为:2H2O+SO2+Br2=H2SO3+2HBr
答案
A.阴离子的电子式要用[]把电子和元素符合括起来,溴离子最外层有8个电子,其电子式为:
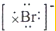
,故A正确;
B.氯气和溴离子能发生置换反应生成溴和氯离子,离子反应方程式为:2Br-+Cl2=Br2+2Cl-,故B正确;
C.氯离子核外有3个电子层,最外层有8个电子,其离子结构示意图为:
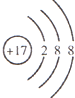
,故C正确;
D.溴具有强氧化性,二氧化硫具有还原性,二氧化硫和溴、水能发生氧化还原反应生成氢溴酸和硫酸,反应方程式为:2H2O+SO2+Br2=H2SO4+2HBr,故D错误;
故选D.
