A-J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去).已知A是一种高熔点物质,D是一种红棕色固体.请回答下列问题:
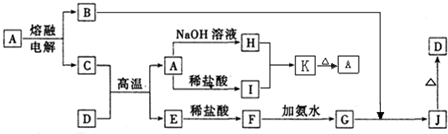
(1)固体A的晶体类型为______,K的化学式为______.
(2)C与D在高温下的反应在冶金工业上称为______反应,引发该反应的实验操作是______.
(3)G→J的化学方程式为______.
(4)A→H的离子方程式为______.
(5)I的水溶液pH______7(填“>”、“<”或“=”),原因是______(用离子方程式表示).
D是一种红棕色固体可知D为Fe2O3,A是一种高熔点物质,电解A得到B与C,考虑A为Al2O3,由转化关系C+Fe2O3
A(Al2O3)+E,故C为Al,E为Fe,A能与氢氧化钠溶液、盐酸反应,A为Al2O3符合转化关系,故B为O2;A与氢氧化钠溶液生成H,A与盐酸反应生成I,H+I→K高温
Al2O3,故H为NaAlO2,I为AlCl3,K为Al(OH)3;△
E(Fe)与盐酸反应生成F,故F为FeCl2,F(FeCl2溶液)中加入氨水生成G,G
JO2
D(Fe2O3),故G为Fe(OH)2,J为Fe(OH)3,△
(1)由上述分析可知,A为Al2O3,属于离子化合物,K为Al(OH)3;
故答案为:离子化合物,Al(OH)3;
(2)C与D在高温下的反应为2Al+Fe2O3
2Fe+Al2O3,在冶金工业上称为铝热反应,引发该反应的实验操作是:在混合粉末上插上镁条,周围撒上少量KClO3,然后点燃镁条; 高温 .
故答案为:铝热,在混合粉末上插上镁条,周围撒上少量KClO3,然后点燃镁条;
(3)G→J是Fe(OH)2被氧化为Fe(OH)3,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(4)A→H是氧化铝与氢氧化钠反应生成偏铝酸钠与水,反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(5)I为AlCl3,AlCl3水溶液中铝离子水解Al3++3H2O⇌Al(OH)3+3H+,溶液呈酸性,pH<7;
故答案为:<,Al3++3H2O⇌Al(OH)3+3H+.
