某化学学习小组为研究HA、HB和MOH的酸碱性的相对强弱,设计以下实验以下实验:将pH═2的两种酸溶液HA,HB和pH=12的MOH碱溶液各1mL,分别加水稀释到1000mL,其pH的变化与溶液体积的关系如图,根据所给的数据,请回答下列问题:
(1)HA为______酸,HB为______酸;(填“强“或“弱“)
(2)若c=9,则稀释后的三种溶液中,由水电离的氢离子浓度的大小顺序为______(用酸、碱化学式表示);将稀释后的HA溶液利MOH溶液取等体积混合,则所得溶液中c(A-)与c(M+)的大小关系为______;(填“大于“、“小于“或“等于“)
(3)若b+c=14,则MQH为______碱(填“强“或“弱“).将稀释后的HB溶液和MOH溶液取等体积混合,所得很合溶液的pH______7(填“大于“、“小于“或“等于“)
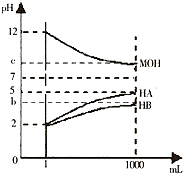
(1)由图可知,pH═2的两种酸溶液HA,HB各1mL,分别加水稀释到1000mL后溶液HA的pH=5,增大3个单位,所以HA为强酸,溶液HB的pH值增大小于3个单位,HB所以为弱酸.
故答案为:强;弱.
(2)pH=5的HA溶液中c(H+)水=c(OH-)水=
=10-9mol/L,所以水电离的氢离子浓度c(H+)水=10-9mol/L.10-14 10-5
pH=b的HB溶液中c(H+)水=c(OH-)水=
=10-(14-b)mol/L,b<5,所以10-(14-b)mol/L<10-9mol/L.10-14 10-b
pH=9的MOH溶液中,c(H+)水=1×10-9 mol/L,
所以水电离的氢离子浓度顺序为MOH═HA>HB.
pH=12的MOH碱溶液1mL,加水稀释到1000mL后pH=9,pH降低3个单位,MOH为强碱.
将稀释后的HA溶液和MOH溶液取等体积混合,二者恰好完全反应生成强酸强碱盐,溶液显中性,根据电荷守恒可知c(A-)=c(M+).
故答案为:MOH═HA>HB; 等于.
(3)若b+c=14,则b=14-c,在pH=c的MOH溶液中c(OH-)=10c-14 mol/L=10-b mol/L,即c(OH-)=10-2 mol/L的MOH稀释103倍后c(OH-)≠10-5 mol/L,所以MOH是弱碱.因为同温度下,HB和MOH的电离能力相同,所以将稀释后的HB溶液和MOH溶液取等体积混合,反应后溶液呈中性.
故答案为:弱;等于.
