问题
选择题
下列说法正确的是( )
A.因为NaHCO3溶于水后,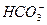 不能完全电离成H+和
不能完全电离成H+和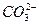 ,所以NaNCO3属于弱电解质
,所以NaNCO3属于弱电解质
B.弱电解质溶液的导电性一定比强电解质溶液的导电性差
C.浓度相同(即单位体积内含有的分子数相同)的HCl和CH3COOH,前者导电能力比后者强,CH3COOH肯定是弱电解质
D.在熔融状态下不能电离的电解质就是弱电解质
答案
答案:C
NaHCO3溶于水后完全电离,电离出Na+和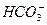 ,NaHCO3是强电解质。
,NaHCO3是强电解质。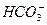 这种弱酸酸式根离子能否继续完全电离,不影响NaHCO3是强电解质的论断。溶液的导电性与离子浓度有关,不能笼统由溶液的导电性确定电解质的强弱,因为稀的电解质溶液可能比浓的弱电解质溶液中离子浓度还低,导电性还差。HCl和CH2COOH两种一元酸在浓度相同时导电性不同,可以说明电解质相对强弱的关系,能说明CH3COOH肯定是弱电解质,即相对弱的一定是弱电解质,相对强的不一定是强电解质。熔融状态下不电离的电解质,在水溶液中可能完全电离,如硫酸,不能只根据在熔融状态下的电离情况就认定为是非电解质。
这种弱酸酸式根离子能否继续完全电离,不影响NaHCO3是强电解质的论断。溶液的导电性与离子浓度有关,不能笼统由溶液的导电性确定电解质的强弱,因为稀的电解质溶液可能比浓的弱电解质溶液中离子浓度还低,导电性还差。HCl和CH2COOH两种一元酸在浓度相同时导电性不同,可以说明电解质相对强弱的关系,能说明CH3COOH肯定是弱电解质,即相对弱的一定是弱电解质,相对强的不一定是强电解质。熔融状态下不电离的电解质,在水溶液中可能完全电离,如硫酸,不能只根据在熔融状态下的电离情况就认定为是非电解质。
