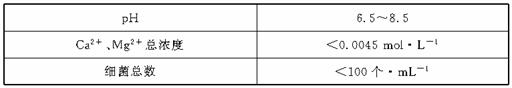
以下是原水处理成自来水的工艺流程示意图
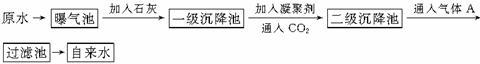
(1)原水中含Ca2+、Mg2+、HCO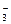 、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_________________________________
、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_________________________________
(2)凝聚剂除去悬浮固体颗粒的过程 (填写编号,多选倒扣)
①只是物理过程 ②只是化学过程 ③是物理和化学过程FeSO4·7H2O是常用的凝聚剂,它在水中最终生成 沉淀。
(3)通入二氧化碳的目的是 和 。
(4)气体A的作用是 。这种作用是基于气体A和水反应的产物具有 性。
(5)下列物质中, 可以作为气体A的代用品。(填写编号)
①Ca(ClO)2 ②浓氨水 ③K2FeO4 ④SO2
(1)HCO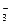 +OH-===CO
+OH-===CO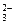 +H2O
+H2O
Mg2++2OH-===Mg(OH)2↓
Ca2++HCO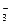 +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
任选其一,其他合理解也给分。
(2)③ 胶状Fe(OH)3
(3)除去Ca2+ 调节pH
(4)杀菌消毒 强氧化
(5)①③
(1)含Ca2+、Mg2+、HCO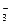 、Cl-的水中加入Ca(OH)2可发生多种反应:HCO
、Cl-的水中加入Ca(OH)2可发生多种反应:HCO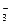 +OH-===CO
+OH-===CO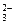 +H2O,Mg2++2OH-===Mg(OH)2↓,Ca2++HCO
+H2O,Mg2++2OH-===Mg(OH)2↓,Ca2++HCO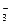 +OH-===CaCO3↓+H2O等等。
+OH-===CaCO3↓+H2O等等。
(2)加入FeSO4·7H2O Fe2+被氧化为Fe3+,再水解生成胶状Fe(OH)3吸附水中杂质而沉淀。
(3)通入CO2目的,除去剩余Ca(OH)2,即Ca2+和OH-。
(4)气体A应为Cl2,因与水反应生成次氯酸具有强氧化性而杀菌消毒。
(5)应选强氧化剂。
