(15分)回答下列各小题:
(1)已知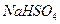 在水中的电离方程式为
在水中的电离方程式为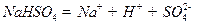 。在
。在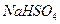 溶液
溶液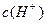 __________
__________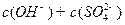 (填“>”“=”或“<”,1分)。
(填“>”“=”或“<”,1分)。
(2)常温下,向1.0mol/L的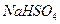 溶液中逐滴加入等物质的量浓度的
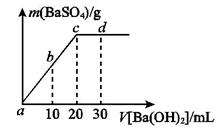
溶液中逐滴加入等物质的量浓度的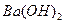 溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________(2分)。
溶液,生产沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点表示溶液呈_________(填“酸性”“中性”或“碱性”,1分),c点所示的离子方程式为______________________________________________________(2分)。
(3)在T℃时,将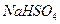 晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将__________25℃(填“高于”或“低于”,1分),K
晶体加入到pH=6的蒸馏水中,保持温度不变,测得溶液的pH为2。T℃将__________25℃(填“高于”或“低于”,1分),K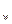 为__________(1分),在该溶液中由水电离出的
为__________(1分),在该溶液中由水电离出的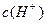 为__________mol·L-1(1分)。T℃时,将pH=11的NaOH溶液V1L与pH=1的
为__________mol·L-1(1分)。T℃时,将pH=11的NaOH溶液V1L与pH=1的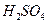 溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________(2分),此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________(2分)。
溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1: V2 =____________(2分),此溶液中各种离子的浓度由大到小的排列顺序为________________________________________________(2分)。
(4)0.1 mol·L-1pH为4的NaHB溶液中①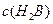 、②
、②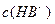 、③
、③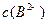 由大到小的顺序为_______________(2分)。
由大到小的顺序为_______________(2分)。
(5)在0.1 mol·L-1的①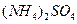 溶液、②
溶液、②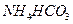 溶液、③
溶液、③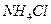 溶液中,
溶液中,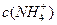 由大到小的排列顺序为_______________________(2分)。
由大到小的排列顺序为_______________________(2分)。