下列反应方程式书写正确的是
A.铜锌原电池(电解质溶液为稀硫酸)的正极反应:2H+ + 2e— = H2↑
B.将少量金属钠投入乙醇的水溶液中:
2CH3CH2OH+2Na=2CH3CH2O-+2Na++H2↑
C.氢氧化钡固体与氯化铵晶体充分混合:NH4++OH-=NH3↑+H2O
D.CH3COOH溶液与NaOH溶液反应:H++ OH-=H2O
答案:A
下列反应方程式书写正确的是
A.铜锌原电池(电解质溶液为稀硫酸)的正极反应:2H+ + 2e— = H2↑
B.将少量金属钠投入乙醇的水溶液中:
2CH3CH2OH+2Na=2CH3CH2O-+2Na++H2↑
C.氢氧化钡固体与氯化铵晶体充分混合:NH4++OH-=NH3↑+H2O
D.CH3COOH溶液与NaOH溶液反应:H++ OH-=H2O
答案:A
 (Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)
(Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g)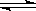 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:
 |






 回答下列问题:
回答下列问题:
 ⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
 2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
 则N2(g)+3H2(g)
则N2(g)+3H2(g)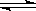 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。


 (2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
(2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
Ⅱ:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa
时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ, 写出表示N2H4燃烧热的热化学方程式是 。
写出表示N2H4燃烧热的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。肼—空气燃料电池放电时:
|
(3)右图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,
铜片的质量变化128g,则肼一空气燃料电池理论
上消耗标准状况下的空气 L
(假设空气中氧气体积含量为20%)