问题
单项选择题
将氢氧化钠稀溶液滴加到醋酸稀溶液中,下列各图示意混合溶液有关量或性质的变化趋势,错误的是()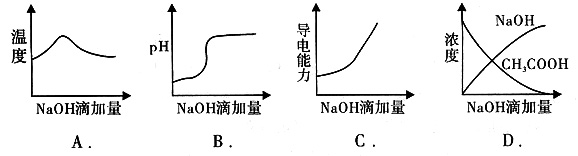
A.选项A
B.选项B
C.选项C
D.选项D
答案
参考答案:D
解析:
本题涉及中和热、pH、溶液的导电能力等知识点。向醋酸中滴加NaOH溶液,起始时发生中和反应放出热量,反应混合液的温度升高,恰好全部反应时,溶液的温度达到最高点,当醋酸全部反应后,再加入NaOH溶液则混合液的温度降低;向醋酸中滴加NaOH溶液,起始时溶液的pH会缓慢升高,在接近终点时pH发生突跃,随后再滴加NaOH溶液,溶液的pH(此时显碱性)变化不大;因醋酸是弱电解质,溶液中离子浓度小,导电能力弱,当向醋酸中滴加NaOH溶液时生成强电解质醋酸钠,溶液的导电能力增强.当反应结束时离子浓度增加幅度更大,导电能力更强;向醋酸中滴加NaOH溶液,起始时加入的NaOH被消耗,故c(NaOH)在起始一段时间内应为0。
