下列叙述中正确的是()
A.向含有CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2
C.等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同
D.向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出
参考答案:D
解析:
本题涉及碳酸盐与碳酸氢盐之间的转化问题。在含有碳酸钙沉淀的溶液中通入二氧化碳恰好生成碳酸氢钙,其与碳酸氢钠混合不发生反应,不会生成碳酸钙沉淀,A错;碳酸钠与盐酸反应是分步反应,等物质的量的氯化氢与碳酸钠反应只生成碳酸氢钠,不能生成二氧化碳: ,B错;等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应:
,B错;等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应:
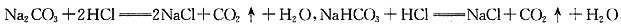 ,产生的二氧化碳在同条件下体积比为84:106=42:53,C错;向碳酸钠饱和溶液中通入足量二氧化碳,生成碳酸氢钠,由于碳酸氢钠溶解度小于碳酸钠的溶解度,且溶剂减少、生成溶质质量增多,故析出碳酸氢钠晶体,
,产生的二氧化碳在同条件下体积比为84:106=42:53,C错;向碳酸钠饱和溶液中通入足量二氧化碳,生成碳酸氢钠,由于碳酸氢钠溶解度小于碳酸钠的溶解度,且溶剂减少、生成溶质质量增多,故析出碳酸氢钠晶体,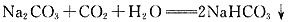 ,D正确。
,D正确。
