根据要求回答下列各题
(Ⅰ)现有 ①铝 ②NH3③氢氧化钠溶液 ④液态氯化氢 ⑤AgCl固体⑥冰醋酸 ⑦蔗糖,填空回答(填序号):
以上物质中(1)属于电解质的是 ;(2)属于非电解质的是 ;
(3)属于强电解质的是 ;(4)能导电的是 。
(Ⅱ)写出下列反应的化学方程式:
①有NaHCO3生成的化合反应
② 有MgCl2参加的分解反应
③ 有Fe2O3参加的置换反应
④ 有HNO3生成的复分解反应
(Ⅲ).同温同压条件下,同体积的CH4和SO2的质量之比是 ;同质量的CH4和SO2的体积之比是 ;若两者所含原子个数总数相等,则CH4和SO2的质量之比是 。
(Ⅳ)把铁片和石墨棒用下列a、b两种方式放在盛有稀硫酸钠溶液和酚酞试液混合溶液的玻璃器皿中,经过一段时间后,首先观察到溶液变红的区域是 (填序号)。
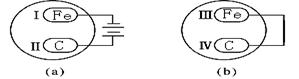
A.Ⅰ和Ⅲ附近
B.Ⅰ和Ⅳ附近
C.Ⅱ和Ⅲ附近
D.Ⅱ和Ⅳ附近
(共12分,每空1分)(Ⅰ)(1)④⑤⑥( 2)②⑦(3)④⑤(4)①③(Ⅱ)①2NaOH+CO2+H2O=2NaHCO3或NaOH+CO2=NaHCO3 ② MgCl2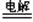 Mg+Cl2↑③ Fe2O3+2Al
Mg+Cl2↑③ Fe2O3+2Al 2Fe+Al2O3 ④ AgNO3+HCl=HNO3+AgCl(合理就给分)(Ⅲ).1:4 4:1 3:20 ; (Ⅳ)B
2Fe+Al2O3 ④ AgNO3+HCl=HNO3+AgCl(合理就给分)(Ⅲ).1:4 4:1 3:20 ; (Ⅳ)B
题目分析:(Ⅰ)电解质和非电解质都是化合物,从这个前提下进行分析,则答案为(1)④⑤⑥( 2)②⑦ (3)④⑤ (4)①③ 。(Ⅱ)联系平时所学的基础知识,完成化学方程式如答案所示。(Ⅲ).同温同压条件下,同体积的CH4和SO2的物质的量相同,则其质量之比是摩尔质量之比,则为1:4 ;同质量的CH4和SO2的体积之比是其摩尔质量的反比。若两者所含原子个数总数相等,假设都为1mol转化为CH4和SO2的质量之比是3:20 。(Ⅳ)a是电解池,b为原电池,在a中相当于电解水,在铁棒上氢离子放电,周围呈碱性,后者是吸氧腐蚀,在碳棒周围会生成氢氧根,因此首先观察到溶液变红的区域是Ⅰ和Ⅳ附近。
