现有浓度为0.1 mol·L-1的五种电解质溶液:
① Na2CO3 ② NaHCO3 ③ NaAlO2 ④ CH3COONa ⑤ NaOH
(1)这五种溶液的pH由小到大的顺序是______(填编号);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是______(填编号);
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
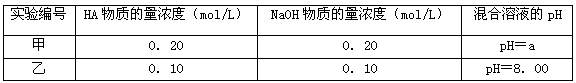
不考虑乙组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸_________________________;
乙组实验所得混合溶液中由水电离出的c (OH-)=____________mol/L。 求出该混合溶液中下列算式的值,要求写出推理、计算过程。
I.c (Na+)-c (A-): ________________________________________________________________________________________;
II.c (OH-)-c (HA): _________________________________________________________________________________________。
(1)④②①③⑤ ;
(2)⑤ ;
(3)a=7时,HA是强酸;a>7时,HA是弱酸 ; 1.0×10-6 ;
I.由溶液中阴阳离子电荷守恒关系得: c (Na+)+c (H+)=c (A-)+c (OH-)
故c (Na+)-c (A+)=c (OH-)-c (H+)=10-6-10-8 =9.9×10-7 mol/L;
II.由溶液中的物料守恒关系得: c (A-)+c (HA) =0.05 mol/L
得:c (Na+) +c (H+)+c (HA)=c (OH-) +0.05 mol/L
c (OH-)-c (HA) = c (Na+) +c (H+)-0.05= 0.05+c(H+)-0.05=c (H+)= 1.0×10-8 mol/L 或由于水电离出的OH-、H+个数比1︰1(即溶液中质子电荷守恒关系)得: c (OH-) = c (HA) +c (H+)
故c (OH-)-c (HA) = (H+)=1.0×10-8 mol/L
