曲线C上任一点到点E(-4,0),F(4,0)的距离的和为12,C与x轴的负半轴、正半轴依次交于A、B两点,点P在C上,且位于x轴上方,PA⊥PF.
(Ⅰ)求曲线C的方程;
(Ⅱ)求点P的坐标.
(I)设G是曲线C上任意一点,依题意,|GE|+|GF|=12.
所以曲线C是以E、F为焦点的椭圆,且椭圆的长半袖a=6,半焦距c=4,
所以短半轴b=
=62-42
,20
所以所求的椭圆方程为
+x2 36
=1;y2 20
(II)设点P的坐标为(x,y)
则
=(x+6,y),AP
=(x-4,y),由已知得 FP
+x2 36
=1y2 20 (x+6)(x-4)+y2=0
则 2x2+9x-18=0,解之得x=-6或x=3 2
当x=-6时,y=0,与y>0矛盾,舍去;
当x=
时,y2=3 2
,取y=75 4
(舍负)5 3 2
∴P(
,3 2
).5 3 2

 2SO3(g) △H=-196.6 kJ·mol-1
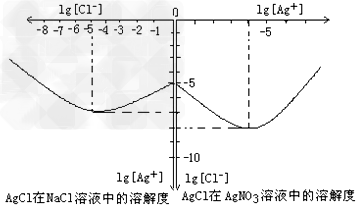
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。