研究化学反应原理对于生产生活是很有意义的.
(1)下列关于醋酸的叙述正确的是______(填写符号).
a.醋酸俗名冰醋酸,是食醋的主要成分
b.向醋酸溶液中加入一定量NaOH固体,溶液的导电性增强
c.加水稀释醋酸溶液,溶液中的所有离子浓度均减小
d.常温下,醋酸溶液中水的电离程度减小
(2)牙釉质对牙齿起着保护作用,其主要成分为Ca5(PO4)3OH,该物质在水中存在沉淀溶解平衡,试写出该物质的溶度积常数表达式Kap=______.
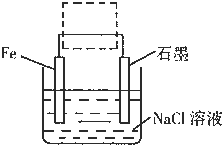
(3)钢铁生锈现象随处可见,钢铁的电化腐蚀原理如图所示:
①写出石墨电极的电极反应式______;
②将该装置作简单修改即可成为钢铁电化学防护的装置,请在右图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向.
③写出修改后石墨电极的电极反应式______.
(1)a.醋酸俗名冰醋酸,食醋的主要成分就是醋酸,故正确;
b.醋酸是弱电解质,醋酸溶液中离子浓度较小,向醋酸溶液中加入一定量NaOH固体,醋酸和氢氧化钠反应生成强电解质醋酸钠,溶液中离子浓度增大,所以溶液的导电性增强,故正确;
c.加水稀释醋酸溶液,促进醋酸电离,但醋酸分子、氢离子和醋酸根离子浓度都减小,根据水的离子积常数知,溶液中氢氧根离子浓度增大,故错误;
d.常温下,醋酸能电离出氢离子,所以能抑制醋酸溶液中水的电离程度,从而使水的电离程度减小,故正确;
故选abd;
(2)Kap=c(Ca2+)5c(PO43-)3c(OH-),故答案为:Kap=c(Ca2+)5c(PO43-)3c(OH-);
(3)①中性条件下,钢铁发生吸氧腐蚀,铁作负极,石墨作正极,正极上氧气得电子生成氢氧根离子,所以电极反应式为:O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
②要保护钢铁不受腐蚀,可以把铁设计成电解池的阴极,与电源负极相连接,阴极上氢离子得电子生成氢气,
导线中电子中电子从负极沿导线流向阴极,从阳极沿导线流向正极,故答案为:如图所示
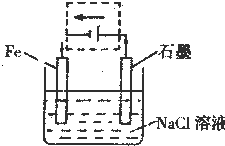
③设计成电解池后,石墨作阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl-2e-=Cl2↑,
故答案为:2Cl-2e-=Cl2↑.

