(1)水的电离平衡曲线如图所示,若A点表示25°C时水的电离达平衡时的离子浓度,B点表示100°C时水的电离达平衡时的离子浓度.100°C时1mol•L-1 的
NaOH溶液中,由水电离出的c(H+)=______mol•L-1,
KW(25°C)______ KW(100°C)(填“>”、“<”或“=”之一).25°C时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是______(填“促进”“抑制”或“不影响”之一).
(2)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
②25℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则c(Na+)______c(CH3COO-)(填“>”、“<”或“=”之一).
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:______.
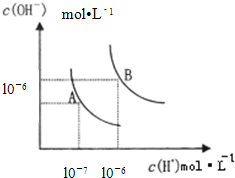
(1)25℃时纯水中C(H+)=C(OH-)=10-7 mol/L,Kw=C(H+).C(OH-)=10-14 ,当温度升高到100℃,纯水中C(H+)=C(OH-)=10-6 mol/L,Kw=C(H+).C(OH-)=10-12 ;
100°C时1mol•L-1 的NaOH溶液中Kw=C(H+).C(OH-)=10-12 ;c(OH-)=1mol/L,水电离出的c(H+)=1×10-12;水的电离时吸热过程,加热促进电离氢离子浓度和氢氧根离子浓度增大,Kw增大,所以KW(25°C)<KW(100°C); NH4Cl固体溶解后溶液中铵根离子水解生成一水合氨和氢离子,溶液呈酸性,水的电离被促进;
故答案为:1×10-12;<;促进;
(2)①依据图表数据分析,醋酸电离常数大于氰酸大于碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度等浓度的Na2CO3溶液>NaCN溶液>CH3COONa溶液,溶液PH为Na2CO3溶液的>NaCN溶液的>CH3COONa溶液的;
故答案为:Na2CO3溶液的>NaCN溶液的>CH3COONa溶液的;
②等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,c(H+)<c(OH-)依据溶液中电荷守恒c(H+)+c(Na+)=c(OH-)+c(CH3COO-),c(Na+)>c(CH3COO-);
故答案为:>;
③向NaCN溶液中通入少量CO2 ,H2CO3酸性大于HCN大于HCO3-,所以反应生成氰酸和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3;
故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
