常温下,浓度均为0.1mol/L的四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③盐酸 ④氨水
试回答下列问题:
(1)上述溶液中有水解反应发生的是______(填编号,下同),溶液中溶质存在电离平衡的是______;
(2)比较①、②溶液,pH值较大的是______;
(3)在溶液④中加入少量NH4Cl固体,此时C(NH4+)/C(OH-)的值将______(填“变小”、“变大”或“不变”);
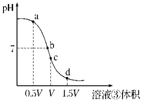
(4)用溶液③滴定V mL溶液④其滴定曲线如图所示:
①试分析在滴定过程中,滴定曲线上a、b、c、d四点,水的电离程度最大的是______点,理由是______;
②a点溶液中离子浓度大小关系是______;
③取少量c点溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系是______.
(1)能水解的是盐溶液中的弱离子的性质,溶质存在电离平衡的是弱电解质或弱酸酸式酸根离子;①Na2CO3溶液是强碱弱酸盐,碳酸根离子水解; ②NaHCO3溶液强碱弱酸盐,碳酸氢根离子水解;碳酸氢根离子存在电离平衡;③盐酸 是强酸;④氨水是弱碱存在电离平衡,故答案为:①②;②④;
(2)同浓度的:①Na2CO3溶液 ②NaHCO3溶液 碳酸钠水解程度大于碳酸氢钠;溶液的pH①>②,故答案为:①;
(3)氨水中一水合氨是弱电解质,存在电离平衡,加入氯化铵,铵根离子抑制电离,平衡逆向进行,氢氧根离子浓度减小,铵根离子浓度增大;此时C(NH4+)/C(OH-)的值将增大,
故答案为:变大;
(4)①用溶液③盐酸滴定V mL溶液④氨水,溶液PH随反应进行减小,到恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,此时促进水的电离;依据0.1mol/L的氨水溶液Vml和0.1mol/L的盐酸溶液恰好反应需要溶液体积为Vml,确定c点是恰好反应;酸过量或碱碱过量对水的电离起到抑制作用,
故答案为:c;恰好完全反应生成氯化铵溶液时,铵根离子水解显酸性,促进水的电离,酸过量或碱碱过量对水的电离起到抑制作用;
②a点反应情况是:0.1mol/L的氨水溶液Vml和0.1mol/L的盐酸溶液0.5VL反应,溶液中为同浓度的氯化铵和一水合氨的混合溶液;依据一水合氨电离大于铵根离子的水解分析判断溶液中的离子浓度为:c(NH4+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
③取少量c点NH4Cl溶液于试管,再滴加0.1mol/L NaOH溶液至中性.此时溶液中除H+、OH-外,离子浓度大小关系可以依据溶液中电荷守恒得到c(H+)+c(NH4+)+c(Na+)=c(OH-)+c(Cl-);溶液中除H+、OH-外存在的离子浓度关系为:c(NH4+)+c(Na+)=c(Cl-),故答案为:c(NH4+)+c(Na+)=c(Cl-).
