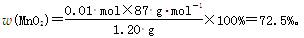(10分)已知高锰酸钾、二氧化锰在酸性条件下能将草酸钠(Na2C2O4)氧化:
MnO4—+C2O42—+H+―→Mn2++CO2↑+H2O(未配平);
MnO2+C2O42—+H+―→Mn2++CO2↑+H2O(未配平)。
为测定某软锰矿中二氧化锰的质量分数,准确称量1.20 g软锰矿样品,加入2.68 g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0 mL,用0.0200 mol·L-1高锰酸钾溶液进行滴定。当加入20.0 mL溶液时恰好完全反应,试根据以上信息完成下列各题:
(1)配平上述两个离子方程式:
___MnO+___C2O+___H+===___Mn2++___CO2↑+___H2O;
___MnO2+__C2O+___H+===___Mn2++___CO2↑+__H2O。
(2)欲求得软锰矿中二氧化锰的质量分数,还缺一个数据,这个数据是__________(填数据所代表的意义)。
(3)若该数据的数值为250,求该软锰矿中二氧化锰的质量分数(写出计算过程)。(4分)
(10分) (1)2 5 16 2 10 8
1 1 4 1 2 2
(2)容量瓶的容积
(3)
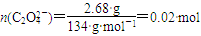 ,
,
滴定250 mL稀释后的溶液,消耗n(MnO4—)=0.0200 mol·L-1×0.02 L×10=0.004 mol,
根据氧化还原反应中得失电子数相等,有
n(MnO2)×2+0.004 mol×5=0.02 mol×2,
n(MnO2)=0.01 mol,
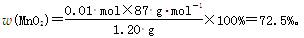
(1)化学方程式的配平,Mn +7→+2价,C由+3→+4价,结果为2 5 16 2 10 8
Mn +4→+2价,C由+3→+4价,结果为1 1 4 1 2 2
(2)容量瓶的容积,否则无法确定取出的溶液的浓度。
(3)
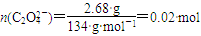 ,
,
滴定250 mL稀释后的溶液,消耗n(MnO4—)=0.0200 mol·L-1×0.02 L×10=0.004 mol,
根据氧化还原反应中得失电子数相等,有
n(MnO2)×2+0.004 mol×5=0.02 mol×2,
n(MnO2)=0.01 mol,