已知H2B为二元弱酸,请回答下列问题:
(1)①Na2B溶液呈______(填酸性”、碱性”或中性”)
②若升高Na2B溶液的温度,则c(HB-)和c(B2-)比值将______(填增大”、减小”或不变”)
(2)某温度下,在0.1mol/L的NaHB溶液中,以下关系一定不正确的是______.
A.C(H+)•C(OH-)=1×10-14
B.pH>7
C.C(OH-)=2C(H2B)+C(HB-)+C(H+)
D.C(HB-)<0.1mol/L
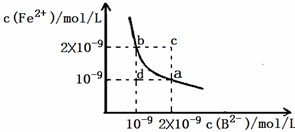
(3)某温度下,FeB在水中的沉淀溶解平衡曲线如图所示.
①写出FeB在水中的沉淀溶解平衡的方程式:______.
②该温度下,将FeB固体加入水中,得到的悬浊液中c(Fe2+)为:______mol/L(保留小数点后1位).
③根据图象,下列说法正确的是:______.
A.a 点对应的Ksp等于b点对应的Ksp
B.通过蒸发可以使溶液由c点变到a点
C.d 点无FeB沉淀生成
D.若改变条件,使FeB的溶解度发生变化,则FeB的Ksp也一定会发生变化.
①Na2B是强碱弱酸盐,水解使溶液呈碱性,故答案为:碱性.
②盐类水解是吸热反应,升高温度,促进盐类的水解,所以c(HB-)和c(B2-)比值将增大,故答案为:增大.
(2)A、水的离子积常数与温度有关,与溶液的酸碱性、浓度无关,所以A可能正确;
B、此溶液是强碱弱酸盐,水解溶液呈碱性,pH值可能>7,所以B可能正确;
C、溶液中氢氧根离子的来源为:H2O=H++OH-、B2-+H2O=HB-+OH-、HB-+H2O=H2B+OH-,所以C(OH-)=C(H2B)+C(HB-)+C(H+),故C错误;
D、由于弱离子的水解,所以C(HB-)<0.1mol/L,故D正确;
故答案为:C;
(3)①由图象知其电离出的阴阳离子,故答案为:FeB(s)
Fe2+(aq)+B2-(aq);溶解
②由图象知KSP=C(Fe2+ )C( B2- )=2×10-9×10-9=2×10-18,
由FeB(s)
Fe2+(aq)+B2-(aq)知c(Fe2+ )=c( B2- ),溶解
c(Fe2+ )=
=1.4×10-9mol/L,故答案为:1.4×10-9;KSP
③A、在沉淀溶解平衡曲线上的点表示的Ksp相等,故A正确;
B、Ksp受温度影响,升温时,Ksp会发生变化,则通过升温不可能由c点变到a点,故B错误;
C、在d点,还未达到FeB的Ksp,则不会生成沉淀,故C正确;
D、此温度下,KSP=c(Fe 2+ )•c(B 2- )=2×10-9×10-9=2×10-18,故D错误;
故答案为:AC.
