可逆反应达平衡后,若反应速率常数k发生变化时,标准平衡常数K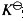 符合下列哪一条()
符合下列哪一条()
A.一定发生变化
B.不变
C.不一定变化
D.与k无关
参考答案:C
解析:
k为反应速率常数,与反应的温度和催化剂因素有关。而平衡常数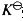 受到以下因素影响。
受到以下因素影响。
(1)浓度对化学平衡的影响。
在一定温度下,当一可逆反应达到平衡后,若增加反应物浓度或者减少生成物浓度(则Q<K),化学平衡向正反应方向移动;增加生成物浓度或减少反应物浓度(则Q>K),化学平衡向逆方向移动。
(2)压力对化学平衡的影响。
对于有气态物质参加的反应来说,某一气态物质的分压变化或反应容器体积的变化,都会引起反应系统总压的改变。增加总压力,使平衡向气体分子总数减少的方向移动;降低总压力,使平衡向气体分子总数增加的方向移动。如果反应前后气态物质的分子总数相等,例如
CO(g)+H2O(g)≒CO2(g)+H2(g)
则无论增加或减小总压力,都不能影响化学平衡。
(3)温度对化学平衡的影响。
温度不仅对化学反应速度有影响,而且,温度的变化会使平衡常数的数值改变,从而使平衡移动。
如果正反应是吸热反应,则温度升高使平衡常数增大,即平衡向正反应方向移动;如果正反应是放热反应,温度升高使平衡常数减小,即平衡向逆反应方向移动。
温度对化学平衡影响的实质是:升高温度使正、逆反应速率都增大,但增大的倍数不等。
在可逆反应中,升高温度使吸热反应的速率比放热反应的速率增加得更多一些,因此平衡就向吸热方向移动。反之,降低温度,平衡就向热方向移动。
(4)催化剂的影响。
催化剂只能以同样倍数增加正、逆反应速率,不能使平衡移动。
综上所述,各种外界条件对化学平衡的影响,可按吕·查德理(Le Chatelier)原理来判断,即当体系达到平衡后,如果改变体系平衡条件(浓度、压力或温度)之一,平衡将向减弱这个改变的方向移动。
因此浓度只影响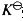 而不影响k,故选(C) 。
而不影响k,故选(C) 。
