问题
单项选择题
下列叙述正确的是()
A.1.00molNaCl中含有6.02×1023个NaCl分子
B.1.00molNaCl中,所有Na+的最外层电子总数为8×6.02×1023
C.欲配制1.00L1.00mol·L-1的NaCl溶液,可将58.5gNaCl溶于1.00L水中
D.电解58.5g熔融的NaCl,能产生22.4L氯气(标准状况)、23.0g金属钠
答案
参考答案:B
解析:
本题主要涉及物质的量、物质的量浓度、阿伏加德罗常数及相关计算。NaCl是离子化合物,故A错;Na+最外层有8个电子,所以1.00molNa+的最外层电子总数为8×6.02×1023,故B正确;欲配制1.00LNaCl溶液,所需水的体积应小于1.00L,故C错;电解58.5g熔融的NaCl,根据电解方程式: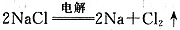 得出生成标况下11.2L氯气,故D错。
得出生成标况下11.2L氯气,故D错。
