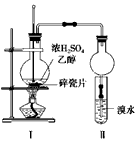
①常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,比较两溶液的pH,盐酸______(填“<”、“=”或“>”)醋酸,写出醋酸电离的方程式______.
②测得某溶液的pH=6.5,且氢离子与氢氧根离子物质的量相等,此溶液呈______性.测定温度______室温(填高于、低于或等于),其理由是______.
①氯化氢是强电解质,在水中完全电离,所以盐酸溶液中氢离子浓度等于盐酸浓度,醋酸是弱电解质,在水中只有部分电离,醋酸溶液中氢离子浓度小于醋酸浓度,所以相同浓度的盐酸和醋酸溶液,醋酸溶液中氢离子浓度小于盐酸溶液中氢离子浓度,导致盐酸溶液的PH值小于醋酸溶液的pH值;醋酸的电离方程式为:CH3COOH⇌CH3COO-+H+,
故答案为:<;CH3COOH⇌CH3COO-+H+;
②该溶液中氢离子的物质的量等于氢氧根离子的物质的量,溶液的体积相同,所以氢离子浓度等于氢氧根离子浓度,溶液呈中性;室温下溶液pH=7时呈中性,该温度下pH=6.5时溶液呈中性,说明促进了水的电离,水的电离是吸热的,升高温度能促进水的电离,所以该温度大于室温,
故答案为:高于;升高温度,能促进水的电离,导致中性溶液的pH值小于7.