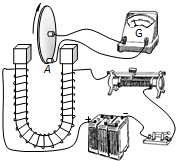
已知H2R2O4在水溶液中存在以下电离:
一级电离:H2R2O4
H++HR2O4- △ .
二级电离:H2R2O4-
H++R2O42- △ .
请回答一下问题:
(1)将0.1mol•L-1的NaOH溶液与0.05mol•L-1的H2R2O4溶液等体积混合,冷却至室温测得溶液的pH______(填“等于7”、“大于7”或“小于7”)
(2)NaHR2O4溶液______(填“呈酸性”、“呈碱性”或“无法确定”).原因是______.
(3)某温度下,在0.1mol•L-1的NaHR2O4溶液中,以下关系一定不正确的是______
A c(H+)•c(OH-)=1×10-14mol2•L-2
B pH>1
C c(OH-)=2c(H2R2O4)+c(HR2
)+c(H+)O -4
D c(Na+)=0.1mol•L-1≥c(R2
).O 2-4
(1)0.1mol•L-1的NaOH溶液与0.05mol•L-1的H2R2O4溶液等体积混合恰好生成Na2R2O4,已知 HR2O4-⇌H++R2O42-说明R2O42-能水解,故Na2R2O4显碱性,所以PH>7;故答案为:PH>7.
(2)HR2O4-在水溶液中存在电离平衡和水解平衡两种,以电离为主时,溶液显酸性,以水解为主时,溶液显碱性,所以无法确定NaHR2O4溶液的酸碱性,
故答案为:无法确定;NaHR2O4溶液中同时存在HR2O4 -⇌H++R2O42-,HR2O4¯+H2⇌H2R2O4+OH¯,因两个平衡程度无法确定,故难以确定溶液酸碱性;
(3)A、常温下,任何溶液中离子积表达式Kw=c(H+)•c(OH-)=1×10-14均成立,故A正确;
B、NaHR2O4溶液中弱离子不能完全电离,所以0.1mol•L-1的NaHR2O4溶液中氢离子浓度小于0.1mol/L,pH>1,故B正确;
C、根据0.1mol•L-1的NaHR2O4溶液中的质子守恒c(OH-)=c(H2R2O4)-c(R2O42-)+c(H+),故C错误;
D、c(Na+)=0.1mol•L-1,R2O42-离子是HR2O4 -部分电离形成的,故一定比钠离子浓度小,故D错误.
故选C、D;

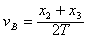 ,还可以用VB=
,还可以用VB=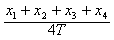 来求,哪一个更接近B点速度?
来求,哪一个更接近B点速度?