二元弱酸是分步电离的,25时碳酸和草酸的Ka如表:
| H2CO3 | Ka1=4.3×10-7 | H2C2O4 | Ka1=5.6×10-2 |
| Ka2=5.6×10-11 | Ka2=5.42×10-5 |
A.0.1mol•L-1的Na2C2O4溶液B.0.1mol•L-1的NaHC2O4溶液
C.0.1mol•L-1的Na2CO3溶液D.0.1mol的NaHCO3溶液
其中,c(H+)最大的是______,c(OH-)最大的是______.
(2)某化学实验兴趣小组同学向用大理石和稀盐酸制备CO2后残留液中滴加碳酸钠溶液,在溶液中插人pH传感器,测得pH变化曲线如图所示.
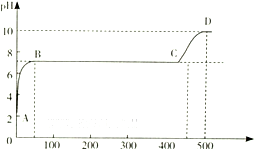
刚开始滴人碳酸钠溶液时发生反应的离子方程式为______,BC段发生反应的离子方程式为______,D点时混合溶液中由水电离产生的c(OH-)=______mol•L-1.
(1)相同条件下,酸的电离平衡常数越大,则酸的酸性越强,酸根离子的水解程度越小,则溶液中氢氧根离子浓度越小,氢离子浓度越大,根据电离平衡常数知,酸性强弱顺序是:草酸>草酸氢根离子>碳酸>碳酸氢根离子,离子水解强弱顺序是:碳酸根离子>碳酸氢根离子>草酸根离子>醋酸氢根离子,
根据离子水解程度知,草酸氢根离子水解程度最小,则其溶液碱性最弱,氢离子浓度最大,所以氢离子浓度最大的是B,水解程度最强的是C,则溶液C中碱性最强,氢氧根离子浓度最大,
故答案为:B;C;
(2)溶液pH<7,说明溶液呈酸性,酸和碳酸钠溶液反应生成氯化钠和水、二氧化碳,离子方程式为:2H++CO32-=H2O+CO2↑,当pH不变时,碳酸钠和氯化钙发生复分解反应,离子方程式为Ca2++CO32-=CaCO3↓,碳酸钠为强碱弱酸盐,其溶液呈碱性,D点时混合溶液中由水电离产生的c(OH-)=
mol/L=10-4 mol/L,10-14 10-10
故答案为:2H++CO32-=H2O+CO2↑;Ca2++CO32-=CaCO3↓;10-4.
