合成氨反应N2(g)+3H2(g) 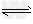 2NH3(g) ΔH=-94.2kJ·mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示。请回答下列问题:
2NH3(g) ΔH=-94.2kJ·mol-1,分别在反应条件不同,但体积均为2L的三个固定体积的容器中反应,起始时N2、H2和NH3的物质的量分别为2mol、6mol、0mol,N2的物质的量随时间的变化如图所示。请回答下列问题:
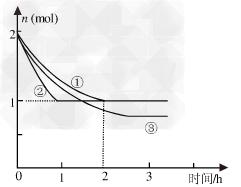
(1)与①比较,②和③分别仅改变一种 反应条件。所改变的条件是: ②___________________;③__________________;
(2)实验①的平衡常数K=____________(用最简分数表示),该反应进行到2h时的平均反应速率vH2=______________;
(3)氨是工业合成尿素(H2NCONH2)的重要原料,工业上合成尿素的反应分为如下两步:
第1步:2NH3(l)+CO2(g)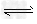 H2NCOONH4(氨基甲酸铵) (l) △H1= -330.0 kJ·mol-1
H2NCOONH4(氨基甲酸铵) (l) △H1= -330.0 kJ·mol-1
第2步:H2NCOONH4(l) 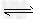 H2O(l)+H2NCONH2(l) △H2=+226.0 kJ·mol-1
H2O(l)+H2NCONH2(l) △H2=+226.0 kJ·mol-1
则2NH3(l)+CO2(g) 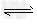 H2O(l)+H2NCONH2 (l) △H=______________。
H2O(l)+H2NCONH2 (l) △H=______________。
(4)工业上利用反应 3Cl2 + 2NH3 =N2 + 6HCl 检查氯气管道是否漏气。当转移6 mol 电子时,生成氮气在标准状况下的体积是_________L。
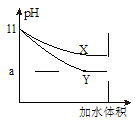
(5)相同pH的氨水和NaOH溶液加水稀释相同的倍数,pH变化曲线如图所示,则x曲线代表的物质是______,当a=9时,稀释后溶液的体积是稀释前溶液体积的_______倍。
(1)加入催化剂 ;降低温度。
(2)16/27 L2·mol-2 ;0.75 mol·L-1·h-1
(3)-104 kJ·mol-1
(4)22.4
(5)氨水 ;100
