(12分)某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积。设计的简易实验装置如图。
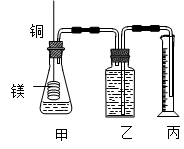
该实验的主要操作步骤如下:
a.配制浓度均为1 mol·L-1盐酸和醋酸溶液;
b.用 ① 量取10.00 mL1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
c.分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为 ② g;d.在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;e.将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录 ③ ;
f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应 ④ ,读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
(1)用文字表述d检查该装置气密性的操作与观察方法: ⑤ 。
(2)本实验中应选用 ⑥ (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(3)简述速率不等的原因 ⑦ ,铜丝不与酸接触的原因是 ⑧ 。
①酸式滴定管 (1分) ② 0.12 (2分)③反应时间 ( 1分) ④将量筒缓缓向下移动,使乙、丙中液面相平(或调节乙、丙仪器中的液面使之相平) ( 2分)
⑤两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气(只要表述明确、合理均可) ;(2分)
⑥B;( 1分) ⑦酸的浓度相同时c(H+)不同 ( 2分)
⑧防止形成原电池,干扰实验现象的观察 ( 1分)
题目分析:量取10.00 mL1 mol·L-1由于要准确量取,所以用酸式滴定管或者移液管都行
分别称取除去表面氧化膜的镁带a g,要保证足够反应,氢离子和镁的反应定量关系是2:1,所以镁至少是0.10mol 质量至少0.12g ;将铜丝向下移动,使足量镁带浸入酸中,至反应完全,记录反应时间。 f.反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应将量筒缓缓向下移动,使乙、丙中液面相平;检查该装置气密性的操作与观察方法:两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气,量筒量取的体积大于100ml 所以选择就近的200ml量程。
速率不等的原因酸的浓度相同时c(H+)不同,浓度不同,反应速率就不同,铜丝不与酸接触的原因是 防止形成原电池,干扰实验现象的观察 。
点评:对于实验,一定要时刻记住实验目,做题时,在每一步,都是保证实验目的的达成,所以做题时把实验目的标出来。
