亚氯酸钠(NaClO2)是一种重要的消毒剂,主要用于水、砂糖、油脂的漂白与杀菌。以下是制取亚氯酸钠的工艺流程:
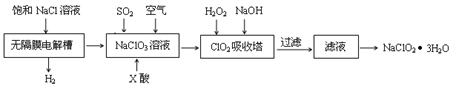
已知:①NaClO2的溶解度随着温度升高而增大,适当条件下可结晶析出。
②ClO2气体只能保持在稀释状态下以防止爆炸性分解,且需现合成现用。
③ClO2气体在中性和碱性溶液中不能稳定存在。
(1)在无隔膜电解槽中持续电解一段时间后,生成氢气和NaClO3,请写出阳极的电极反应方程式: 。
(2)反应生成ClO2气体需要X酸酸化的原因为: 。X酸为 。
(3)吸收塔内的温度不能过高的原因为:
(4)吸收塔内ClO2随着还原剂的不同和溶液酸碱性的变化可被还原为ClO2—或Cl—。ClO2被S2—还原为ClO2—、Cl—的转化率与溶液pH的关系如右图所示。
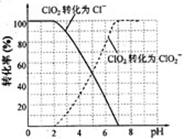
请写出pH≤2时ClO2与S2—反应的离子方程式: 。
(5)第二步向NaClO3溶液中通SO2的同时通入空气的原因为: 。
(6)从滤液中得到NaClO2●3H2O粗晶体的操作步骤为
、 、 。
(12分)(1) Cl—+6e—+6OH—=ClO3—+3H2O (2) ClO2只能在酸性环境中存在;硫酸
(3)防止H2O2分解 (4) 2ClO2+5S2—+ 8H+ =2Cl—+5S↓+4H2O
(5)稀释ClO2气体,防止爆炸 (6)蒸发浓缩、冷却结晶、过滤
题目分析:(1)电解池中阳极失去电子,所以溶液中的氯离子在阳极失去电子,因此反应的电极反应式是Cl—+6e—+6OH—=ClO3—+3H2O。
(2)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在。由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸。
(3)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解。
(4)根据图像可知,pH≤2时ClO2被还原为Cl—,所以该反应的离子方程式是2ClO2+5S2—+ 8H+ =2Cl—+5S↓+4H2O。
(5)由信息②可知,纯ClO2易分解爆炸,一般用稀有气体或空气稀释,目的是稀释ClO2气体,防止爆炸。
(6)从溶液中得到含结晶水的晶体,只能采取蒸发、浓缩、冷却结晶方法,通过过滤得到粗晶体,所以从滤液中得到NaClO2·3H2O粗晶体的操作步骤为蒸发浓缩、冷却结晶、过滤。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生解题能力的培养和方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范严谨的实验设计能力。本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考察学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用、有关实验操作和简单实验设计能力考察以及在新情境下综合运用知识解决问题的能力,题目有一定的难度。
