问题
选择题
下列说法不正确的是( )
A.Na2CO3溶液中c(OH-)大于c(HCO)
B.水的离子积常数为KW,若溶液中c2(OH-)=KW,溶液pH可能小于7
C.1 mol/L的CH3COOH溶液加水稀释时,溶液中某种离子浓度可能增大
D在CH3COOH溶液中加入溶于水溶液呈碱性的固体物质,平衡一定向电离方向移动
答案
答案:D
Na2CO3溶液中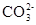 发生水解产生OH-和HCO但是HCO会继续水解生成碳酸和OH-,所以溶液中c(OH-)大于c(HCO),A正确;KW与温度有关,当温度是25℃时KW=10-14若
发生水解产生OH-和HCO但是HCO会继续水解生成碳酸和OH-,所以溶液中c(OH-)大于c(HCO),A正确;KW与温度有关,当温度是25℃时KW=10-14若
c2(OH-)=KW,常温下可以得到pH=7,但是当温度低于25℃时,KW<10-14,所得的pH小于7,所以B正确;1 mol/L的CH3COOH溶液加水稀释时溶液的酸性逐渐减弱,溶液中氢离子的浓度逐渐减小,氢氧根的浓度逐渐增大,C正确;加入溶于水溶液呈碱性的固体物质可能是碱也可能是水解显碱性的盐,如CH3COONa,若加入的物质是CH3COONa,加入了CH3COO-抑制电离电离平衡向电离方向的反方向移动,D错误;所以答案选D
