(14分)下列物质中,①NaCl;②NaOH;③NH3·H2O;④CH3COOH溶液;⑤BaSO4;⑥H2O;⑦HCl;⑧H2SO4 ⑨CO2;⑩酒精溶液(均填写编号回答)
⑴是弱电解质的有 ,是非电解质的有 。
⑵pH相等的②的溶液和③的溶液等体积加水稀释相同倍数后,pH大的是 。
⑶有pH均为2的④、⑦、⑧三种物质的溶液,物质的量浓度大到小的顺序为 ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是 。
(4)某温度时,0.01 mol•L-1的醋酸溶液电离平衡常数为1. 0×10 -8,醋酸的电离平衡常数表达式为 ,达平衡时,溶液中氢离子浓度是 ,当向该溶液中加入一定量的盐酸时,电离常数 发生变化(填是、否)。
(5)将pH=1的盐酸平均分成2份,1份加适量水,另1份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入了水与NaOH溶液的体积比为 。
⑴③⑥,⑨;⑵③;⑶ ④⑦⑧,a﹤b=c。
(4) K= 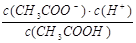 ,4.18×10 -4 mol•L-1 ,否。 (5)11:1
,4.18×10 -4 mol•L-1 ,否。 (5)11:1
(1)弱电解质包括:弱酸、弱碱、水、极个别的盐;④CH3COOH溶液是混合物,故不属于弱电解质;
(2)NaOH是强碱,完全电离,NH3·H2O是弱碱,部分电离,且存在NH3·H2O的电离平衡;加水稀释相同倍数后,NH3·H2O的电离平衡正向移动,故[OH-]:NH3·H2O>NaOH,所以,pH大的是③NH3·H2O;
(3)④CH3COOH是弱酸 ⑦HCl是一元强酸 ⑧H2SO4是二元强酸,三者PH相等,即自由移动的H+浓度相等,则物质的量浓度大到小的顺序为:CH3COOH(c>0.01mol.L-1)>HCl(c=0.01mol.L-1)>H2SO4(c=0.005mol.L-1);
对HCl、H2SO4,均是:H+ + OH- = H2O
1 1
则中和含等物质的量NaOH的溶液时,[H+]HClb=[H+]H2SO4c,因为[H+]HCl=[H+]H2SO4,所以b=c,
CH3COOH +NaOH= CH3COONa+H2O ,则c(CH3COOH)a =等物质的量NaOH,而c(CH3COOH) >[H+]HCl=[H+]H2SO4,所以a<b=c;
(4) CH3COOH CH3COO-+H+
CH3COO-+H+
C0 0.01 0 0
△C x x x
C(平衡) 0.01-x x x
则:x2/( 0.01-x)= 1.0×10 -8,得:[H+]=" x" =4.18×10 -4 mol•L-1
平衡常数仅受温度影响,故加入一定量的盐酸时,电离常数不发生变化;
(5)PH由1变到2,即H+浓度由0.1mol•L-1变到0.01mol•L-1,
第一份加水:0.01mol•L-1=[0.1×V(HCl)]/[ V(HCl)+V(H2O)],得:V(H2O)=9V(HCl),
第二份加碱:0.01mol•L-1=[0.1×V(HCl)- 0.1×V(NaOH)]/[ V(HCl)+V(NaOH)],得:V(NaOH)=9/(11V),
所以:V(H2O):V(NaOH)= 11:1
