向明矾[KAl(SO4)2·12H2O]溶液中逐滴加入Ba(OH)2溶液至过量。
(1)写出可能发生的有关反应的化学方程式。 。
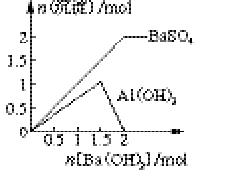
(2)在图中,纵坐标表示生成沉淀的物质的量,横坐标表示加入Ba(OH)2的物质的量。试在图中画出当溶液中明矾为1 mol时,生成的每一种沉淀的物质的量随Ba(OH)2物质的量变化的曲线(在曲线上标明沉淀的化学式)。
(3)向a L物质的量浓度为M mol/L的明矾溶液中滴加物质的量浓度为n mol/L的Ba(OH)2溶液b L,用含a、M、n的表达式表示:
①当b满足________条件时,沉淀的总物质的量为最大值;
②当b满足________条件时,沉淀的质量为最大值。
(1)2KAl(SO4)2+3Ba(OH)2=K2SO4+3BaSO4↓+2Al(OH)3↓(1分)
K2SO4+2Al(OH)3+Ba(OH)2=2KAlO2+BaSO4↓+4H2O(1分)
(2)  (4分)(3)①1.5aM=nb(1分) ②2aM=nb(1分)
(4分)(3)①1.5aM=nb(1分) ②2aM=nb(1分)
题目分析:(1)当明矾中铝离子恰好形成氢氧化铝沉淀时,反应的化学方程式为2KAl(SO4)2+3Ba(OH)2=K2SO4+3BaSO4↓+2Al(OH)3↓;由于氢氧化铝是两性氢氧化物,所以当明矾中SO42-恰好反应生成硫酸钡白色沉淀时,此时溶液中反应的离子方程式为K2SO4+2Al(OH)3+Ba(OH)2=2KAlO2+BaSO4↓+4H2O。
(2)根据反应式2KAl(SO4)2+3Ba(OH)2=K2SO4+3BaSO4↓+2Al(OH)3↓可知,当加入1.5mol氢氧化钡时生成1.5mol硫酸钡和1mol氢氧化铝。根据反应式KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O可知,当加入2mol氢氧化钡时,生成的氢氧化铝又溶解生成偏铝酸钠,此时硫酸钡的沉淀达到最大值,因此图像可表示为 。
。
(3)①根据反应2KAl(SO4)2+3Ba(OH)2=K2SO4+3BaSO4↓+2Al(OH)3↓和KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O可知,当沉淀的物质的量最大时明矾与氢氧化钡的物质的量之比=2:3,则1.5aM=nb。
②同样根据反应可知,当恰好生成硫酸钡沉淀时沉淀质量最大,此时明矾与氢氧化钡的物质的量之比=1:2,则2aM=nb。
