问题
填空题
有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol•L-1,b mol•L-1,c mol•L-1,其大小顺序为__________。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为n 1mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为____________。
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为____________
答案
(1)a=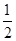 b>c (2)n1=n2=n3 (3)V1=V3=1/2V2 (4)v2>v1>v3
b>c (2)n1=n2=n3 (3)V1=V3=1/2V2 (4)v2>v1>v3
盐酸是一元强酸,硫酸是二元强酸,醋酸是一元弱酸,存在电离平衡。所以
(1)a=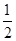 b>c
b>c
(2)由于酸根的物质的量都是相同的,因此生成的盐的物质的量也是相同的,即n1=n2=n3。
(3)在氢氧化钠相同的条件下,需要硫酸的量少,因此答案是V1=V3=1/2V2。
(4)氢离子浓度越大,反应速率越快,所以根据(1)可知,反应速率是v2>v1>v3.
