问题
选择题
某温度下HF的电离常数Ka=3.3×10-4 mol·L-1,CaF2的溶度积常数Ksp=1.46×10-10(mol·L-1)3。在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合。下列说法正确的是( )
A.该温度下,0.31 mol·L-1的HF溶液的pH=2
B.升高温度或增大浓度,HF的电离平衡常数都将增大
C.两溶液混合不会产生沉淀
D.向饱和的CaF2溶液中加水后,c(Ca2+)一定比加水前减小
答案
答案:A
题目分析:A、电离常数Ka(HF)=3.3×10-4,HF为弱电解质,不能完全电离,25℃时,0.31mol/LHF溶液中c(H+)=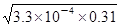 =1×10-2mol/L,pH=1,故A正确;B、电离常数只受温度的影响,不随浓度的变化而变化,故B错误;C、0.31 mol/L的HF溶液中c(H+)=c(F-)=1×10-2mol/L。故C错误;在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合后c(F-)=0.5×10-2mol/L,c(Ca2+)=0.001mol/L,则c2(F-)×c(Ca2+)=(0.5×10-2)2×0.001=2.5×10-8>1.46×10-10,因此该体系中有CaF2沉淀产生,故C不正确。D、向饱和的CaF2溶液中加水后,溶液还可能是饱和的,所以c(Ca2+)不一定比加水前减小,D不正确,答案选A。
=1×10-2mol/L,pH=1,故A正确;B、电离常数只受温度的影响,不随浓度的变化而变化,故B错误;C、0.31 mol/L的HF溶液中c(H+)=c(F-)=1×10-2mol/L。故C错误;在该温度下取浓度为0.31 mol·L-1的HF与浓度为0.002 mol·L-1的CaCl2溶液等体积混合后c(F-)=0.5×10-2mol/L,c(Ca2+)=0.001mol/L,则c2(F-)×c(Ca2+)=(0.5×10-2)2×0.001=2.5×10-8>1.46×10-10,因此该体系中有CaF2沉淀产生,故C不正确。D、向饱和的CaF2溶液中加水后,溶液还可能是饱和的,所以c(Ca2+)不一定比加水前减小,D不正确,答案选A。
