I、NaOH、FeCl3是中学化学实验室常用的试剂。
(1)在一定条件下能与NaOH溶液反应的固体单质有________和________(举两例)。
配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的原因是________。
A.容量瓶中原有少量蒸馏水
B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中;
C.定容时观察液面俯视
D.溶解后未经冷却立即转移至容量瓶内(2)FeCl3可以腐蚀蚀刷电路铜板,反应的离子方程式为________________________________K2FeO4是一种强氧化剂,可作为水处理剂和高容量电池材料。K2FeO4可以由与FeCl3 与KClO在强碱性条件下反应制得,其反应的离子方程式为
______________________________________________.
Ⅱ丙烷在燃烧时能放如大量的热,它也是液化石油气的主要成分,作为能源应用于人们
的日常生产和生活。
已知:
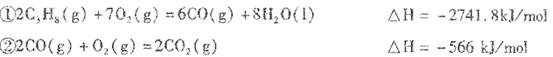
(1)反应
(2)依据(1)中的反应可以设计一种新型燃料电池,一极通人空气,另一极通入丙烷气体:燃料电池内部是熔融的掺杂着氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在其内部可以传导O2-。在电池内部O2-移向_________极(填“正”或“负”);电池的负极反应为_____________________________.
(3)用上述燃料电池用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液。电解开始后阴极的现象为_______________________________________________。
Ⅰ(1)铝、硅(硫) B
(2)2 Fe3+ +Cu="=2" Fe2+ + Cu2+
3ClO-+2 Fe3++10OH-="2" FeO42-+3Cl-+5H2O
Ⅱ(1)-2219.2KJ/mol
(2)负 C3H8+10O2-—20e-=3CO2+4H2O
(3)有大量无色气泡产生,并且有白色沉淀产生。
题目分析:(l)与NaOH溶液反应的固体单质有金属铝,和非金属单质硅硫。
配制一定物质的量浓度的NaOH溶液时,A.容量瓶中原有少量蒸馏水,不影响所配溶液浓度。B.洗涤烧杯和玻璃棒的溶液未转入容量瓶中,溶质减少,浓度减小。C. D操作都是所加溶剂少于正常读数的溶剂,所配溶液浓度偏大。
(2) FeCl3可以腐蚀电路铜板,就是Fe3氧化铜单质。
FeCl3 与KClO在强碱性条件下制备K2FeO4,利用KClO的强氧化性。
Ⅱ,(1)利用盖斯定律,(①+②×3)/2, C3H8(g)+5O2(g)=3CO2(g)+4H2O (l) △H=-2219.2KJ/mol
(2)原电池电解质溶液中阴离子移向负极。电池的负极发生氧化反应。
(3) 用惰性电极电解足量Mg(NO3)2和NaCl的混合溶液,阴极发生还原反应,2H++2e-=H2↑,阴极周围溶液中2OH-+Mg2+=" Mg" (OH)2↓.
