下列说法或表达正确的是( )
①活性炭、SO2和HClO都具有漂白作用,且漂白的化学原理相同
②向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:
2Fe2++4Br-+3Cl2="2" Fe3++2Br2+6Cl-
③因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>S
④酸性条件下KIO3溶液与KI溶液发生反应生成I2时的离子方程式:
IO3-+5I-+3H2O=I2+6OH-
⑤碳酸氢根离子的电离方程式可表示为: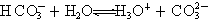
⑥元素周期表中,从上到下,卤族元素的非金属性逐渐减弱,氢卤酸的酸性依次减弱
⑦500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)  2NH3 (g) △H=-38.6kJ·mol-1
2NH3 (g) △H=-38.6kJ·mol-1
A.全部
B.②⑤
C.②③④⑦
D.②④⑦
答案:B
题目分析:①活性炭的漂泊是吸附作用,属于物理变化,HClO的漂泊是利用了HClO的强氧化性,SO2的漂泊是SO2与有颜色的物质发生了非氧化反应,生成无色物质,漂泊原理不同,错误;②FeBr2与Cl2的物质的量之比为1:5,Cl2过量,离子方程式正确;③HClO与稀硫酸的氧化性强弱和非金属性无关,错误;④酸性条件下,不可能生成OH‾,错误;⑤生成的H3O+为H+,正确;⑥元素周期表中,从上到下,氢卤酸的酸性依次增强,错误;⑦因为N2与H2的反应为可逆反应,所以0.5mol N2与1.5mol H2不可能完全反应,无法求算∆H,错误。
