问题
选择题
醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述不正确的是
H++CH3COO-,下列叙述不正确的是
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(CH3COO-)+c(OH-)
B.物质的量浓度相等CH3COOH和CH3COONa混合溶液:
c(CH3COO-)-c(CH3COOH)=2 c(H+)-2 c(OH-)
C.CH3COOH溶液加水稀释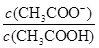 不变
不变
D.CH3COOH溶液加水稀释,溶液中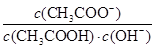 不变
不变
答案
答案:C
题目分析:A、根据电荷守恒可知,醋酸溶液中离子浓度的关系满足: c(H+)=c(CH3COO-)+c(OH-),A正确;B、根据电荷守恒可知,物质的量浓度相等CH3COOH和CH3COONa混合溶液中c(Na+)+c(H+)=c(CH3COO-)+c(OH-)。根据物料守恒可知,c(CH3COO-)+c(CH3COOH)=2 c(Na+),所以关系式c(CH3COO-)-c(CH3COOH)=2 c(H+)-2 c(OH-)正确,B正确;C、稀释促进电离,CH3COO-物质的量增加,CH3COOH减少,所以CH3COOH溶液加水稀释,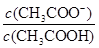 增大,C不正确;D、根据醋酸的电离常数可知Ka=
增大,C不正确;D、根据醋酸的电离常数可知Ka=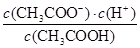 ,则Ka=
,则Ka=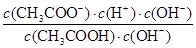 =
=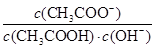 ×Kw,所以CH3COOH溶液加水稀释,溶液中
×Kw,所以CH3COOH溶液加水稀释,溶液中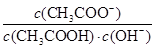 不变,D正确,答案选C。
不变,D正确,答案选C。
