已知25℃时弱电解质电离平衡常数:
Ka(CH3COOH) l.8 xl0-5,Ka(HSCN) 0.13
(1)将20mL,0.10mol/L CH3COOH溶液和20mL,0.10mol/L的HSCN溶液分别与0.10mol/L的NaHCO3溶液反应,实验测得产生CO2气体体积(V)与时间t的关系如图。

反应开始时,两种溶液产生CO2的速率明显不同的原因是 ;
反应结束后所得溶液中c(SCN-)____ c(CH3COO-)(填“>”,“=”或“<”)。
(2)2.0×l0-3mol/L的氢氟酸水溶液中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-),c(HF)与溶液pH的关系如下图。

则25℃时,HF电离平衡常数为:(列式求值)Ka(HF)=
(3)难溶物质CaF2溶度积常数为:Ksp= 1.5×10-10,将4.0×10-3mol/L HF溶液与4.0×l0-4 mol/L的CaCl2溶液等体积混合,调节溶液pH =4(忽略调节时溶液体积变化),试分析混合后是否有沉淀生成?____ (填“有”或“没有”),筒述理由: 。
(10分)(1)因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+):HSCN>CH3COOH, c(H+)大反应速率快(2分);> (2分)
(2)Ka(HF)=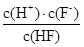 =
=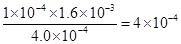 (2分)
(2分)
(3)有(2分)
因为溶液中c(Ca2+)·c2(F-)=5.12×10-10>ksp(CaF2)=1.5×10-10(2分)
题目分析:(1)电离平衡常数大的电离出的离子浓度大,故反应开始时,两种溶液产生CO2的速率明显不同的原因是因为Ka(HSCN)>Ka(CH3COOH),溶液中c(H+):HSCN>CH3COOH,c(H+)大反应速率快。因为电离平衡常数不变,随着反应的进行,电离平衡正向移动,故c(SCN-)>c(CH3COO-)。
(2)电离平衡常数等于电离出的离子浓度的幂之积除以电解质的浓度,故Ka(HF)=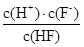 =
=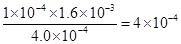 。
。
(3)查图可知当pH=4.0时,溶液中的c(F-)=1.6×10-3mol•L-1,因等体积混合则溶液中c(Ca2+)=2.0×10-4mol•L-1,即c(Ca2+)×c2(F-)=5.12×10-10>Ksp(CaF2))=1.5×10-10,所以有沉淀产生,故答案为:有沉淀产生。
点评:本题考查电离平衡常数与弱电解质的电离、盐类水解的关系及利用溶度积来分析是否有沉淀生成,明确电离平衡常数的表达式和离子积的计算,并借助图来分析解答即可,较好的训练学生利用信息来分析问题、解决问题的能力。
