问题
选择题
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示。下列说法正确的是( )
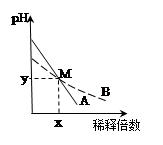
A.稀释前,c(A)> 10 c(B)
B.稀释前,A溶液中由水电离出的OH-的浓度是B溶液中由水电离出的OH-的10倍
C.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
D.M点时A和B的浓度相等
答案
答案:C
题目分析:根据图像可知,稀释相同倍数A的pH相差大,B的pH相差小,所以A是强碱,B是弱碱。如果A、B都是强碱,则pH相差1,c(A)=10c(B),但是B是弱碱不完全电离,所以要电离出相同的OH-,浓度要比强碱大,所以c(A)<10c(B),A项错误;稀释前A的pH比B大于1,所以A溶液中由水电离出的OH-的浓度是B溶液中由水电离出的OH-的0.1倍,B项错误;在M点A、B两溶液的pH相同,所以H+浓度、OH-浓度都相同,根据电荷守恒,两溶液中的阳离子浓度也相同,C项正确;D项错误。答案选C。
点评:强弱电解质在比较时,必须要考虑弱电解质的电离平衡。
